Laporan Praktikum Pemurnian Natrium Klorida (NaCl) dengan Metode Rekristalisasi
PRAKTIKUM KIMA ANORGANIK
“PEMURNIAN NATRIUM KLORIDA DENGAN METODE REKRISTALISASI”
A. Tujuan
- Memahami proses rekristalisasi natrium klorida.
- Memurnikan kristal natrium klorida yang terdapat dalam garam dapur dengan metode rekristalisasi.
- Menguji sifat-sifat natrium klorida hasil rekristalisasi secara kualitatif.
- Menguji kemurnian kristal NaCl secara kualitatif.
B. Dasar Teori
1. Rekristalisasi
Rekristalisasi merupakan suatu metode untuk pemurnian senyawa padatan. Prinsip rekristalisasi adalah perbedaan kelarutan zat pengotornya akibat pelepasan pelarut dari zat terlarutnya (Arsyad, 2001).
2. Kelarutan
Endapan merupakan zat yang memisahkan diri sebagai suatu fase padat keluar dari larutan. Endapan dapat berupa kristal (kristalin) atau koloid dan dapat dikeluarkan dari larutan dengan penyaringan. Endapan terbentuk jika larutan menjadi terlalu jenuh dengan zat yang bersangkutan. Kelarutan suatu endapan adalah sama dengan konsentrasi molar dari larutan jenuhnya (Svehla, 1989).
Berikut ini faktor-faktor penting yang mempengaruhi kelarutan sebagai berikut:
a. Temperatur
Kebanyakan garam anorganik meningkat kelarutannya sejalan dengan peningkatan temperatur.
b. Pemilihan pelarut
Garam-garam anorganik lebih dapat larut dalam air daripada dalam larutan-larutan organik. Air mempunyai momen dipol besar dan ditarik ke kation dan anion untuk membentuk ion-ion hidrat.
c. Efek ion-sekutu
Di sebuah endapan secara umum lebih dapat larut dalam air murni dibandingkan di dalam sebuah larutan yang mengandung satu dari ion-ion endapan (efek ion-sekutu).
d. Efek aktivitas
Banyak endapan menunjukkan peningkatan kelarutan dalam larutan yang mengandung ion-ion yang tidak bereaksi secara kimiawi dengan ion-ion dari endapan. Efek ini dikenal dengan berbagai nama, seperti efek ion lain, efek garam netral, atau efek aktivitas.
e. Efek pH
Kelarutan dari garam sebuah asam lemah tergantung pada pH larutan tersebut. Ion hidrogen bergabung dengan anion dari garam untuk membentuk asam lemah, sehingga meningkatkan kelarutan dari garam.
f. Efek hidrolisis
Jika garam dari asam lemah dilarutkan dalam air akan menghasilkan perubahan [H+]. Kation dari garam mengalami hidrolisis sehingga menambahkan kelarutannya.
g. Efek pembentukan kompleks
Kelarutan dari garam yang sedikit larut juga tergantung atas konsentrasi zat-zat yang membentuk kompleks-kompleks dengan kation garam (Day dan Underwood, 2002).
3. Garam dapur (NaCl)
Air laut sebagai sumber bahan baku pembuatan garam selain mengandung NaCl juga mengandung garam-garam terlarut lainnya sebagai pengotor. Pengotor ini biasanya berasal dari ion-ion Ca2+, SO42-, Fe3+, Mg2+ dan lain-lain. Untuk itu perlu adanya suatu usaha yang dilakukan untuk meningkatkan kemurnian NaCl pada garam tersebut. Salah satu cara yang dapat dilakukan adalah dengan penambahan bahan pengikat untuk mengikat pengotor-pengotor yang sebelumnya sudah ada pada garam dapur melalui pembentukan pengendapan. Bahan pengikat yang ditambahkan adalah CaO, Ba(OH)2, dan (NH4)2CO3 (Lindawati, 2006).
Pengotor yang berasal dari ion sulfat (SO42-) akan membentuk senyawa Ba(SO)4, pengotor dari ion Fe3+ akan membentuk senyawa Fe(OH)3, pengotor dari ion Ca2+ akan membentuk senyawa CaCO3, dan pengotor dari ion Mg2+ akan membentuk senyawa MgCO3 (Lindawati, 2006). Reaksi-reaksi yang terjadi sebagai berikut:
Ba2+(aq) + SO42-(aq) → Ba(SO)4(s)
Fe3+(aq) + 3OH-(aq) → Fe(OH)3(s)
Ca2+(aq) + CO32-(aq) → CaO3(s)
Mg2+(aq) + CO32-(aq) → MgCO3(s)
4. Pengujian Natrium Klorida
Pengujian natrium dapat dilakukan dengan uji nyala. Nyala Bunsen yang tidak cemerlang akan diwarnai kuning oleh uap garam natrium. Warna kuning yang dihasilkan terjadi karena elektron kristal NaCl kembali ke keadaan dasar, elektron-elektron tersebut membebaskan atau memancarkan energi yang jatuh pada panjang gelombang 570-590 nm (Svehla, 1985).
Uji ion klorida merupakan uji adanya ion Cl- dengan mereaksikan dengan AgNO3 dan ditambahkan HNO3 untuk memberikan suasana asam. Penambahan AgNO3 membentuk endapan putih yang merupakan AgCl. Persamaan reaksi yang terjadi sebagai berikut:
NaCl(aq) + AgNO3(aq) → NaNO3(aq) + AgCl(s)
Adanya endapan menunjukkan bahwa kristal yang dihasilkan positif mengandung ion Cl- (Lindawati, 2006).
5. Kristal Natrium Klorida
Natrium klorida mengkristal dalam bentuk kubus pusat muka (FCC) dengan 8 ion Cl- menempati kedelapan sudut suatu kubus dan 6 ion Cl- yang lain menempati keenam pusat muka kubus. Kristal natrium klorida dapat dikatakan memiliki bangun kemas rapat kubus pusat muka ion Cl- dengan ion Na+ yang berukuran lebih kecil menempati rongga oktahedral (Sugiyarto, 2010).
C. Alat dan Bahan
Alat-alat yang digunakan pada percobaan ini adalah gelas ukur, gelas beaker, gelas arloji, sendok sungu, spatula, Bunsen spirtus, corong gelas besar, pengaduk kaca, magnetic stirrer, kawat nikrom, statif dan o-ring, kaca preparate, kertas saring, korek, hot plate, neraca analitik, mikroskop, dan botol akuades.
Bahan-bahan yang digunakan pada percobaan ini adalah garam dapur, padatan CaO, larutan Ba(OH)2 0,3 M, larutan (NH4)2CO3, larutan HCl 0,1 M, larutan HNO3 6 M, larutan AgNO3 0,1 M, dan akuades.
D. Cara Kerja
Langkah kerja yang pertama yaitu pelarutan garam dapur. Garam dapur sebanyak 8 gram dilarutkan dalam 25 mL akuades dengan menggunakan gelas beaker. Larutan tersebut dipanaskan menggunakan hot plate sambil terus diaduk menggunakan magnetic stirrer. Kemudian larutan disaring menggunakan kertas saring.
Langkah kerja yang kedua yaitu rekristalisasi dengan cara penguapan. Padatan CaO sebanyak 0,2 gram dimasukkan ke dalam larutan garam dapur yang telah disaring (filtrat), setelah itu larutan disaring kembali menggunakan kertas saring. Kemudian larutan yang telah disaring ditambahkan larutan Ba(OH)2 sedikit demi sedikit sampai tidak terbentuk endapan. Setelah itu, larutan disaring kembali menggunakan kertas saring lalu ditambahkan larutan (NH4)2CO3 sedikit demi sedikit sambil terus diaduk. Larutan akhir disaring dan dimasukkan ke dalam gelas beaker yang telah ditimbang massanya. Larutan hasil penyaringan ditambahkan 10 mL HCl tetes demi tetes kemudian larutan diuapkan menggunakan hot plate sampai pelarut-pelarutnya menguap seluruhnya dan hampir kering atau terbentuk endapan kristal. Kristal yang dihasilkan ditimbang massanya dan dihitung rendemennya.
Langkah kerja yang terakhir yaitu uji kemurnian kristal. Pertama, uji nyala dengan cara kristal diambil dengan kawat nikrom lalu dipanaskan di atas Bunsen spirtus. Kedua, pengujian ion klorida dengan cara garam kristal 0,01 gram dilarutkan dalam 2 mL akuades yang telah diasamkan sebelumnya dengan 2 tetes HNO3 6 M. Kemudian ditambahkan larutan AgNO3 0,1 M ke dalam larutan tetes demi tetes. Ketiga, bentuk kristal diamat dengan menggunakan mikroskop.
E. Hasil dan Pembahasan
Percobaan yang dilakukan berjudul Pemurnian Natrium Klorida dengan Metode Rekristalisasi. Tujuan dari percobaan ini yaitu untuk memahami proses rekristalisasi natrium klorida, memurnikan natrium klorida yang terdapat dalam garam dapur dengan metode rekristalisasi, menguji sifat-sifat natrium klorida hasil rekristalisasi secara kualitatif, dan menguji kemurnian kristal NaCl secara kualitatif. Prinsip kerja pada percobaan ini adalah metode rekristalisasi melalui pengendapan dan penguapan. Prinsip pengendapan yaitu penambahan ion zat sejenis yang mengakibatkan kelarutan semakin kecil sehingga membentuk endapan. Prinsip penguapan yaitu perbedaan titik didih pelarut yang lebih kecil dibandingkan padatan agar zat yang dilarutkan tidak terurai.
Pada percobaan ini, garam dapur yang digunakan merupakan garam dapur yang belum murni dan air sebagai pelarutnya. Pada perlakuan awal, garam dapur dilarutkan dalam akuades lalu dipanaskan dan diaduk. Tujuan pemanasan yaitu untuk mempercepat pelarutan garam dapur dimana dalam suhu tinggi ion-ion semakin bergerak bebas sehingga mudah larut. Persamaan reaksi yang terjadi sebagai berikut:
NaCl(s) + H2O(l) → Na+(aq) + Cl-(aq)
Larutan garam dapur disaring untuk memisahkan zat pengotor yang berpartikel besar dari filtratnya. Filtrat garam yang dihasilkan direkristalisasi dengan cara penguapan. Filtrat garam dapur ditambahkan CaO. Persamaan reaksi yang terjadi sebagai berikut:
2NaCl(aq) + CaO(s) → CaCl2(s) + Na2O(aq)
Penambahan CaO untuk mengendapkan zat pengotor ion Fe3+ yang membentuk senyawa Fe(OH)3. Setelah ditambahkan CaO, larutan berwarna putih keruh dan terbentuk endapan. Reaksi yang terjadi sebagai berikut:
CaO + H2O → Ca(OH)2
Ca(OH)2 → Ca2+ + 2OH-
Fe3+ + 3OH- → Fe(OH)3
Setelah penambahan CaO, larutan disaring kembali dan dihasilkan filtrat. Filtrat yang dihasilkan ditambahkan larutan Ba(OH)2. Persamaan reaksi yang terjadi sebagai berikut:
CaCl2(aq) + Na2O(aq) + Ba(OH)2(aq) → 2NaOH(s) + BaCl2(aq) + CaO(aq)
Penambahan larutan Ba(OH)2 dilakukan tetes demi tetes sampai tidak terjadi endapan. Penambahan larutan Ba(OH)2 untuk mengendapkan ion-ion yang mungkin masih tersisa setelah penambahan CaO. Endapan yang dihasilkan adalah endapan putih, ion SO42- membentuk senyawa BaSO4. Reaksi yang terjadi sebagai berikut:
Ba2+ + SO42- → BaSO4
Senyawa Ba(OH)2 akan mengendapkan ion Fe3+ dan ion Mg2+ yang membentuk senyawa Fe(OH)3 dan senyawa Mg(OH)2. Reaksi yang terjadi sebagai berikut:
Fe3+ + OH- → Fe(OH)3
Mg2+ + OH- → Mg(OH)2
Setelah penambahan larutan Ba(OH)2, larutan disaring kembali dan dihasilkan filtrat, filtrat yang dihasilkan ditambahkan larutan (NH4)2CO3. Persamaan reaksi yang terjadi sebagai berikut:
2NaOH(s) + BaCl2(aq) + CaO(aq) + (NH4)2CO3(aq) → NaCl(aq) + Ba(OH)2(aq) + CaCO3(s) + NH4Cl(aq)
Penambahan (NH4)2CO3 untuk mengendapkan ion-ion yang mungkin masih ada dalam larutan garam. Ion tersebut adalah ion Ca2+ dan ion Ba2+ yang akan mengendap sebagai senyawa CaCO3 dan BaCO3. Reaksi yang terjadi sebagai berikut:
Ca2+ + CO32- → CaCO3 (endapan putih)
Ba2+ + CO32- → BaCO3 (endapan putih)
Setelah penambahan (NH4)2CO3, larutan disaring kembali dan dihasilkan larutan akhir. Filtrat yang dihasilkan bersifat basa, lalu dinetralisasi dengan larutan yang bersifat asam yaitu HCl. Setelah larutan tersebut netral, larutan diuapkan menggunakan hotplate hingga terbentuk kristal garam dapur kembali. Fungsi penguapan yaitu untuk menghilangkan zat pelarut dan ion-ion lain yang mudah menyerap agar diperoleh NaCl murni.
Berdasarkan percobaan yang dilakukan diperoleh massa kristal NaCl sebanyak 11,14 gram dan rendemen 139,12%. Rendemen yang diperoleh melebihi 100% dikarenakan padatan kristal NaCl yang diperoleh belum kering sempurna dan pelarut-pelarutnya belum menguap seluruhnya sehingga masih terdapat air pada kristal NaCl dan menyebabkan massa kristal yang diperoleh sangat besar (mengandung air).
Pengujian kemurnian kristal dibagi menjadi tiga perlakuan yaitu uji nyala, uji ion klorida, dan uji bentuk kristal, pada uji nyala menghasilkan warna nyala kuning di sekitar kristal NaCl. Warna nyala yang dihasilkan terjadi karena energi dari nyala api diserap oleh elektron pada ion Na+ dengan panjang gelombang tertentu menyebabkan terjadinya eksitasi dan kembalinya elektron ke keadaan dasar membebaskan energi nyala sesuai dengan panjang gelombang yang dimiliki.
Pengujian yang kedua yaitu uji ion klorida dengan mereaksikan kristal NaCl dengan AgNO3 dan air yang telah ditetesi HNO3 untuk memberikan suasana asam. Penambahan AgNO3 membentuk endapan putih yang merupakan AgCl. adanya endapan menunjukkan bahwa kristal yang dihasilkan positif mengandung Cl-. Persamaan reaksi yang terjadi sebagai berikut:
NaCl(aq) + AgNO3(aq) → NaNO3(aq) + AgCl(s)
Pengujian yang ketiga yaitu uji bentuk kristal menggunakan mikroskop. Uji bentuk yang dihasilkan adalah bentuk kubus tetapi masih terdapat pengotor-pengotor yang belum larut atau hilang sempurna pada gambar.
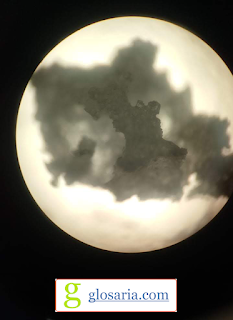 |
| Bentuk Kristal NaCl (Natrium Klorida) |
F. Kesimpulan
Berdasarkan percobaan yang telah dilakukan dapat disimpulkan bahwa:
- Rekristalisasi adalah pemurnian suatu zat padat dari campuran atau pengotornya dengan cara mengkristalkan kembali zat tersebut setelah dilarutkan dalam pelarut yang cocok.
- Pemurnian natrium klorida yang terdapat dalam garam dapur dengan metode rekristalisasi dilakukan dengan cara menambahkan CaO, larutan Ba(OH)2, larutan (NH4)2CO3 untuk mengikat zat pengotor yang ikut larut. Pembentukan kristal NaCl yang telah dimurnikan dengan cara penguapan.
- Uji sifat natrium klorida dengan uji nyala menghasilkan warna kuning berarti mengandung ion Na+. uji ion klorida terdapat endapan AgCl berarti mengandung ion Cl-.
- Menguji kemurnian kristal NaCl dengan cara melihat bentuk kristal NaCl pada mikroskop. Bentuk kristal yang dihasilkan adalah kubus. Rendemen yang dihasilkan sebesar 139,12%.
G. Daftar Pustaka
- Arsyad. 2001. Prinsip-prinsip Kimia Modern. Jakarta: Erlangga
- Day dan Underwood. 2002. Analisis Kimia Kuantitatif. Jakarta: Erlangga.
- Lindawati. 2006. Pengaruh Waktu Penyimpanan dan Pemanasan Terhadap Kadar Iodium dalam Garam Iodium. Semarang: FMIPA UNS.
- Svehla. 1985. Buku Teks Analisis Anorganik Kualitatif Makro dan Semimikro. Jakarta: PT. Kalman Media Pusaka.


Posting Komentar untuk "Laporan Praktikum Pemurnian Natrium Klorida (NaCl) dengan Metode Rekristalisasi"