Laporan Praktikum Struktur Kristal Close Packed Crystal
LAPORAN PRAKTIKUM KIMIA ANORGANIK
STRUKTUR KRISTAL: CLOSE PACKED CRYSTAL
A. Tujuan
- Membuat model dan menentukan struktur octahedral dan tetrahedral pada unit dasar struktur kristal
- Menentukan octahedral hole dan tetrahedral hole pada unit dasar struktur kristal
- Menentukan bilangan koordinasi yang dimiliki masing-masing atom dalam struktur kristal close packed
B. Dasar Teori
1. Kristal
Susunan bahan padat tergantung pada susunan atom-atom, ion-ion, atau molekul-molekul yang saling berikatan. Kristal adalah bahan padat yang atom-atomnya tersusun dalam satu pola yang berulang dalam tiga dimensi yang juga disebut sebagai padatan kristal. Keteraturan atau kekristalan suatu struktur dapat dijumpai pada gas atau cairan. Diantara padatan, logam, keramik, dan polimer dapat berupa kristalin tergantung pada proses pembuatan atau parameter komposisinya (Mangonon, 1999).
2. Close packed
Close packed adalah susunan atom-atom pada struktur logam yang tercemas bersama-sama dan sangat rapat dalam suatu kristal. Konsep kemasan kristal mengasumsikan bahwa atom-atom berupa bole keras dan tentunya mempunyai ukuran yang sama untuk atom yang sama. Pada penataan lapisan heksagonal setiap bola disentuh oleh 6 bola yang lain dan tatanan tersebut merupakan cara yang paling rapat. Oleh karena itu close packed disebut juga dengan kemas rapat.
Kemas rapat bola-bola dengan ukuran yang sama memiliki 2 tipe rongga antara lapis-lapisnya. Ada dua macam rongga dalam suatu kemas rapat sebagai berikut:
a. Rongga tetrahedral (Tetrahedral hole)
Rongga tetrahedral adalah rongga sebagai titik pusat bagian tetrahedron. Jika rongga ini ditempati oleh bola (atom) lain yang tepat ukurannya yaitu tepat menyinggung keempat bole tetrahedron, maka susunan tersebut memiliki bilangan koordinasi 4. Rongga tetrahedral lebih kecil ukurannya daripada rongga octahedral.
b. Rongga oktahedral (Octahedral hole)
Rongga octahedral adalah rongga sebagai titik pusat bangun octahedron. Jika rongga ini ditempati oleh bola (atom) lain yang tepat ukurannya yaitu tepat menyinggung keenam bole octahedron maka atom tersebut mempunyai bilangan koordinasi 6 (Sugiyarto, 2010).
3. Pola Susunan Kristal
Pada kubus sederhana sederhana setiap bola di sudut dibagi oleh delapan sel satuan dan terdapat delapan sudut dalam satu kubus, maka hanya terdapat satu bola (atom) dalam satu sel satuan kubus sederhana. Setiap bola dengan susunan tersebut memiliki bilangan koordinasi 6 karena bola saling bersentuhan dengan empat bola di lapisannya sendiri, satu bola pada lapisan di atasnya dan satu bola pada lapisan di bawahnya.
Pada kubus pusat badan mengandung bola-bola setara dengan dua bola (atom) utuh, satu di pusat dan delapan bola-bola sudut yang dibagi. Setiap bola dengan susunan tersebut memiliki bilangan koordinasi 8 karena setiap bola bersentuhan dengan empat bola pada lapisan di atasnya dan empat bola pada lapisan di bawahnya.
Pada kubus pusat muka mengandung empat bola (atom) utuh, tiga dari enam atom pemusatan sisi dan satu dan satu dari delapan bola-bola sudut yang dibagi. Setiap bola dengan susunan tersebut memiliki bilangan koordinasi 12 karena terdapat bola-bola pada pusat setiap sisi kubus sebagai tambahan terhadap delapan bola-bola di sudut (Chang, 2003).
Hubungan volume ruang suatu kristal yang ditempati atau diisi oleh bola (atom) dengan tipe bangun kemasan kira-kira 52% untuk kubus sederhana, 68% untuk kubus pusat badan, dan 74% untuk kubus pusat muka. Semakin besar persentase volume isian semakin kecil ruang kosong yang ditinggalkan dan semakin dekat atau rapat atom-atom tercemas (Sugiyarto, 2010).
C. Alat dan Bahan
Alat-alat yang digunakan pada percobaan ini adalah jangka sorong, penggaris, dan gunting.
Bahan-bahan yang digunakan pada percobaan ini adalah bola, lem, dan double tape.
D. Cara Kerja
Percobaan yang dilakukan adalah menyusun bola dengan pola heksagonal, segitiga, dan simple cubic masing-masing pola dibuat 2 buah. Percobaan pertama diambil susunan B (pola segitiga) lalu ditempelkan 1 buah bola terpisah pada susunan B sehingga menutupi rongga pada pola B.
Percobaan yang kedua diambil 2 buah susunan B dan disusun ditumpuk berlawanan arah sehingga membentuk octahedral.
Percobaan yang ketiga diambil 2 buah susunan C (pola simple cubic) lalu dibentuk kubus sederhana.
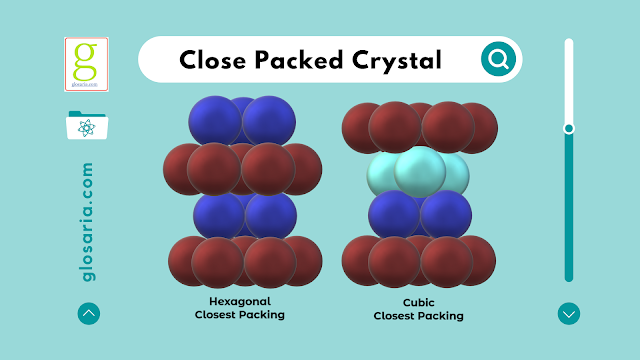
Percobaan yang keempat diambil susunan A (pola heksagonal) dan susunan B (pola segitiga) masing-masing 2 buah lalu disusun dengan pola B-A-B-A sehingga menjadi susunan Hexagonal Closest Packed (HCP).
Percobaan yang terakhir diambil susunan A dan susunan B masing-masing 2 buah lalu disusun dengan pola A-B-B-A sehingga menjadi susunan Cubic Closest Packed (CCP).
E. Hasil dan Pembahasan
Percobaan yang dilakukan berjudul Struktur Kristal: Closed Packed Crystal. Tujuan dari percobaan ini adalah membuat model dan menentukan struktur octahedral dan tetrahedral pada unit dasar struktur kristal, menentukan octahedral hole dan tetrahedral hole pada unit dasar struktur kristal, dan menentukan bilangan koordinasi yang dimiliki masing-masing atom dalam struktur kristal close packed. Prinsip kerja yang digunakan pada percobaan ini adalah close packed yaitu kemas rapat untuk menentukan Faktor Efisiensi Kristal (Packing Efficiency [PE]) struktur kristal.
Percobaan dilakukan dengan disusunnya bola dengan susunan A (pola heksagonal), susunan B (pola segitiga), dan susunan C (pola simple cubic).
 |
| Gambar 2. Susunan B |
 |
| Gambar 3. Susunan C |
Percobaan pertama yaitu diambil susunan B dan 1 buah bola terpisah. 1 buah bola ditempelkan ada susunan B sehingga menutupi rongga pada susunan B dan terbentuk struktur tetrahedral seperti pada Gambar 4.
Jenis lubang yang dihasilkan adalah tetrahedral hole. Pada struktur ini tidak terdapat rongga atau lubang yang bisa dilewati oleh cahaya karena susunan bola yang sangat rapat.
 |
| Gambar 4. Tetrahedral |
Percobaan yang kedua yaitu diambil 2 buah susunan B dan disusun ditumpuk berlawanan arah sehingga terbentuk struktur octahedral seperti Gambar 5.
Jenis lubang yang dihasilkan adalah octahedral hole. Pada struktur ini terdapat rongga kecil di tengah susunan bola sehingga bisa dilewati oleh cahaya.
 |
| Gambar 5. Oktahedral |
Percobaan yang ketiga yaitu diambil dua buah bola susunan C dan disusun sehingga terbentuk struktur kubus sederhana seperti Gambar 6. Pada struktur ini terdapat rongga yang cukup besar karena susunan bola tidak padat dan tidak rapat sehingga bisa dilewati oleh cahaya.
 |
| Gambar 6. Kubus Sederhana |
Pada struktur simple cubic jarak titik kisi diperoleh dari dua kali jari-jari atau diameter pada bola yaitu 6 cm. volume kisi yang diperoleh dari jarak titik kisi dipangkatkan tiga sehingga diperoleh 216 cm3. Luas bidang kisi diperoleh dari jarak titik kisi dipangkatkan dua sehingga diperoleh 36 cm2.
Susunan yang paling rapat adalah struktur octahedral karena cahaya yang melewati struktur octahedral lebih sedikit daripada struktur simple cubic. Celah atau lubang yang terbentuk pada struktur octahedral lebih kecil daripada lubang yang terbentuk pada struktur simple cubic.
Percobaan yang keempat yaitu
diambil susunan A dan B masing-masing dua buah. Kemudian disusun dengan pola
B-A-B-A sehingga terbentuk struktur Hexagonal Closes Packed (HCP) seperti pada
Gambar 7.
Bilangan koordinasi struktur Hexagonal Closes Packed (HCP) adalah 12 karena struktur tersebut dikelilingi oleh 12 atom.
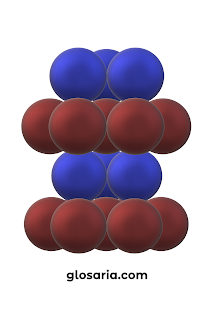 |
| Gambar 7. Hexagonal Closest Packing (HCP) |
Percobaan yang keempat yaitu diambil susunan A dan B masing-masing dua buah. Kemudian disusun dengan pola A-B-A-B sehingga terbentuk struktur Cubic Closest Packing (CCP) seperti pada Gambar 8.
Bilangan koordinasi struktur Cubic Closest Packing (CCP) adalah 12 karena struktur tersebut dikelilingi oleh 12 atom.
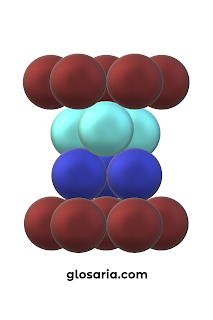 |
| Gambar 8. Cubic Closest Packing (CCP) |
F. Kesimpulan
Berdasarkan percobaan yang telah dilakukan disimpulkan bahwa:
- Struktur dasar tetrahedral terdiri dari 4 ligan membentuk segitiga sama sisi dan octahedral terdiri dari 6 ligan membentuk delapan muka segitiga.
- Octahedral hole adalah lubang yang dihasilkan oleh struktur octahedral. Tetrahedral hole adalah lubang yang dihasilkan oleh struktur tetrahedral.
-
Bilangan koordinasi yang dimiliki oleh
masing-masing atom struktur kristal close packed adalah:
Struktur tetrahedral = 4
Struktur octahedral = 6
Hexagonal Closest Packing (HCP) = 12
Cubic Closest Packing (CCP) = 12
G. Daftar Pustaka
- Chang, R. 2003. General Chemistry: The Essential Concepts alih bahasa: Indra Noviandri dkk, 2004. Kimia Dasar Jilid I. Jakarta: Penerbit Erlangga.
- Mangonon, P. L. 1999. The Principles of Materials Selection for Engineering Design. New Jersey: Printice Hall.
- Sugiyarto, K. H. dan Retno, D. S. 2010. Kimia Anorganik Logam. Yogyakarta: Graha Ilmu.

Posting Komentar untuk "Laporan Praktikum Struktur Kristal Close Packed Crystal"