Sel Volta: Pengertian, Prinsip Kerja, Bagian, Susunan Notasi Sel dan Contoh Penerapannya
 |
| SEL VOLTA |
Glosaria.com - Sel Volta, atau juga dikenal sebagai sel galvani, merupakan salah satu jenis sel elektrokimia yang penting dalam dunia ilmu kimia dan aplikasinya dalam berbagai bidang teknologi. Ditemukan oleh ilmuwan Italia, Alessandro Volta pada tahun 1800, sel ini merupakan cikal bakal bagi banyak perangkat elektronik dan teknologi modern yang kita gunakan hari ini, salah satunya yaitu pada teknologi baterai atau penyimpanan energi listrik. Artikel ini akan menjelaskan pengertian, prinsip kerja, bagian, dan penerapan dari sel Volta serta perbedaannya dengan sel elektrolisis.
Pengertian Sel Volta
Sel Volta adalah perangkat elektrokimia yang menghasilkan arus listrik melalui reaksi redoks (reduksi-oksidasi) antara dua jenis logam yang berbeda yang dicelupkan dalam larutan elektrolit. Sel ini diberi nama sesuai dengan Alessandro Volta, ilmuwan Italia yang pertama kali mengembangkan konsepnya. Sel Volta dikenal sebagai sel galvani atau sel elektrokimia, dan merupakan salah satu bentuk utama dari sel elektrokimia.
Pada dasarnya ada 2 jenis sel elektrokimia, yaitu sel volta atau sel galvani dan sel elektrolisis. Dalam sel volta, reaksi redoks spontan digunakan untuk menghasilkan arus listrik. Contohnya adalah batu baterai dan aki. Dalam sel elektrolisis, arus listrik digunakan untuk melangsungkan reaksi redoks tak spontan. Contohnya adalah elektrolisis air dan penyepuhan.
BACA: Perbedaan Sel Volta dan Sel Elektrolisis Beserta Contohnya
Prinsip Kerja Sel Volta
Prinsip kerja sel Volta didasarkan pada perbedaan potensial elektrokimia antara dua logam yang berbeda yang dicelupkan dalam larutan elektrolit. Proses ini melibatkan dua reaksi redoks, yaitu reaksi oksidasi di satu logam dan reaksi reduksi di logam lainnya. Oksidasi menghasilkan elektron yang bergerak dari logam yang mengalami oksidasi (logam anodik) ke logam yang mengalami reduksi (logam katodik) melalui kawat konduktor eksternal. Inilah yang menciptakan aliran listrik atau arus.
Pada sel volta terjadi reaksi redoks spontan. Reaksi redoks spontan ini menghasilkan aliran elektron atau yang kita sebut dengan listrik. Oleh karena itu, sel volta atau sel galvani sering digunakan dan dimanfaatkan untuk penyimpanan listrik seperti pada baterai dan aki.
Reaksi Redoks Pada Sel Volta
Reaksi redoks spontan adalah reaksi redoks yang berlangsung serta - merta. Contohnya adalah reasksi antara logam zink dengan larutan tembaga (II) Sulfat. Sel seng-tembaga adalah salah satu contoh sederhana dari sel volta, di mana seng bertindak sebagai anoda dan tembaga bertindak sebagai katoda. Seng mengalami oksidasi menjadi ion seng positif (Zn²+), melepaskan elektron, sedangkan tembaga mengalami reduksi, menangkap elektron dan membentuk ion tembaga positif (Cu²2+). Elektron yang dilepaskan dari seng bergerak melalui kawat konduktor ke tembaga, menciptakan aliran listrik.
Jika sepotong logam zink dimasukan ke dalam larutan tembaga (II) Sulfat, segera terjadi reaksi dimana logam zink sedikit demi sedikit melarut sedangkan ion tembaga (ll) diendapkan. Reaksi ini bersifat eksoterm yang ditandai dengan naiknya suhu larutan.
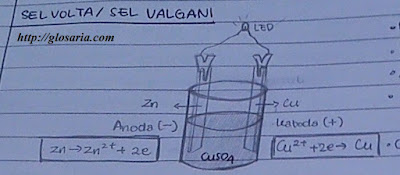 |
| Gambar: Sel volta/ Sel galvani |
Reaksi yang terjadi dapat dituliskan sebagai berikut:
Zn (s) + Cu² (aq) ==> Zn² (aq) + Cu (s)
Sementara itu, reaksi kebalikannya, yaitu reaksi antara logam tembaga dengan larutan zink sulfat (ion Zn²) tidak terjadi. Oleh karena itu , dapat dikatakan bahwa kebalikan dari reaksi spontan adalah tidak spontan.
Susunan Sel Volta
Telah disebutkan bahwa reaksi redoks spontan dapat digunakan sebagai sumber listrik. Perlu di ingat bahwa arus listrik adalah aliran elektron melalui kawat penghantar, jika zink dimasukkan ke dalam larutan ion tembaga (ll), akan terjadi reaksi redoks tetapi tidak ada arus listrik karena tidak ada aliran elektron. Ion - ion Cu² datang ke permukaan logam zink, mengambil dua elektron dan lalu mengendap. Dalam sel volta, reduktor dan oksidatornya dipisahkan sehingga pemindahan elektron tidak terjadi secara langsung tetapi melalui kawat penghantar.
Logam zink yang dicelupkan ke dalam larutan yang mengandung ion Zn² (larutan garam zink ) sementara sepotong logam tembaga dicelupkan dalam larutan ion Cu² (larutan garam tembaga (ll)). Logam zink akan larut sambil melepas dua elektron. Elektron yang dibebaskan tidak memasuki larutan tetapi tertinggal pada logam zink itu. Elektron tersebut selanjutnya akan mengalir ke logam tembaga melalui kawat penghantar. Ion Cu² akan mengambil elektron dari logam tembaga lalu mengendap.
Logam zink dan tembaga yang menjadi kutub - kutub listrik pada rangkaian sel volta disebut elektrode. Secara definisi, elektrode tempat terjadinya oksidasi disebut anode, sedangkan elektrode tempat terjadinya reduksi disebut katode. Oleh karena itu oksidasi adalah pelepasan elektron , maka anode adalah kutub negatif , sedangkan katode merupakan kutub positif. Pada sel volta yang kita bahas di atas, anode adalah logam zink dan katode adalah tembaga.
Notasi Sel Volta
Susunan suatu sel volta dinyatakan dengan suatu notasi singkat yang disebut diagram sel. Anode biasanya digambarkan di sebelah kiri, sedangkan katode di sebelah kanan. Notasi tersebut menyatakan bahwa pada anode terjadi oksidasi Zn menjadi Zn², sedangkan di katode terjadi reduksi ion Cu² menjadi Cu. Dua garis sejajar yang memisahkan anode dan katode menyatakan jembatan garam, sedangkan garis tunggal menyatakan batas antar fase (Zn padatan, sedangkan Zn² dalam larutan, Cu² dalam larutan, sedang Cu Padatan ).
Bagian-Bagian Sel Volta
Sel Volta terdiri dari beberapa komponen utama, yaitu anoda, katoda, larutan elektrolit, dan kawat konduktor.
- Anoda: merupakan bagian logam yang mengalami oksidasi, melepaskan elektron.
- Katoda: adalah logam yang mengalami reduksi, menangkap elektron.
- Larutan Elektrolit: larutan yang mengandung ion-ion yang memungkinkan aliran elektron antara anoda dan katoda.
- Kawat Konduktor: menghubungkan anoda dan katoda, memungkinkan aliran elektron.
- Potensi Elektrokimia: perbedaan potensial elektrokimia antara anoda dan katoda yang menciptakan tekanan listrik untuk aliran elektron.
Jenis-jenis Sel Volta
Pada dasarnya sel volta dibagi menjadi 2 jenis, yaitu sel primer dan sekunder. Perbedaan antara sel primer dan sel sekunder adalah terletak pada kemampuan pengisian ulang energi listriknya. Pada sel primer energi listrik tidak dapat diisi ulang karena reaksinya bersifat tidak dapat balik (irreversible) sedangkan sebaliknya pada sel sekunder energi listrik dapat diisi ulang karena reaksinya bersifat dapat balik (reversible).
1. Sel Volta Primer
Sel volta primer adalah sel yang tidak dapat diisi ulang karena reaksinya tidak dapat balik (irreversible). Sel primer juga dikenal sebagai sel galvanik atau sel voltaik, yaitu salah satu jenis sel elektrokimia yang menghasilkan energi listrik secara langsung melalui reaksi kimia di dalamnya. Contoh dari sel volta primer antara lain yaitu sel kering, sel alkaline, dan sel perak oksida.
2. Sel Volta Sekunder
Sel volta sekunder merupakan sel yang dapat diisi kembali karena reaksinya dapat balik (reversible). Sel sekunder, juga dikenal sebagai sel elektrokimia reversibel atau sel akumulator, yaitu jenis sel elektrokimia yang dapat diisi ulang. Sel sekunder bekerja dengan mengubah energi listrik menjadi energi kimia saat diisi ulang dan mengubah energi kimia menjadi energi listrik saat digunakan. Contoh sel volta sekunder antara lain adalah sel aki, sel Ni-Cd, dan baterai litium. Berikut adalah 3 contoh aplikasi sel sekunder beserta dengan reaksi kimia yang terjadi.
BACA: 3 Contoh Sel Primer dan Sel Sekunder Pada Sel Volta
Penerapan Sel Volta
Sel Volta memiliki berbagai penerapan dalam kehidupan sehari-hari dan industri, beberapa contoh penerapan sel volta antara lain yaitu :
- Baterai: Prinsip kerja sel Volta menjadi dasar bagi baterai kimia modern yang digunakan dalam perangkat elektronik seperti ponsel, laptop, dan mobil listrik.
- Elektrokimia: Digunakan dalam berbagai proses elektrokimia seperti elektrolisis untuk pemisahan logam dari senyawa mereka, serta dalam produksi klorin dan natrium hidroksida.
- Sensor: Sel Volta digunakan dalam sensor elektrokimia untuk mendeteksi konsentrasi zat-zat tertentu dalam larutan, seperti pH atau ion logam.
- Penerangan: Beberapa lampu lalu lintas dan lampu darurat menggunakan sel Volta sebagai sumber daya.
- Pengukuran: Dalam beberapa peralatan laboratorium dan instrumen pengukuran, sel Volta digunakan untuk memberikan daya listrik yang stabil.
Kesimpulan
Sel Volta memiliki peran penting dalam memahami dasar-dasar elektrokimia dan juga telah menginspirasi perkembangan teknologi baterai yang sangat penting dalam dunia modern. Dalam berbagai aplikasinya, prinsip dasar sel Volta tetap relevan dan memberikan kontribusi besar terhadap kenyamanan dan kemajuan teknologi kita saat ini.

Posting Komentar untuk "Sel Volta: Pengertian, Prinsip Kerja, Bagian, Susunan Notasi Sel dan Contoh Penerapannya"