3 Contoh Sel Primer dan Sel Sekunder Pada Sel Volta
Glosaria.com - Sel Volta adalah jenis sel elektrokimia yang pertama kali ditemukan oleh Alessandro Volta pada tahun 1800. Pada dasarnya sel volta ini terdiri dari dua buah elektroda yang terendam dalam larutan elektrolit, yang memungkinkan aliran arus listrik melalui reaksi kimia antara elektroda dan elektrolit. Dalam sel Volta, terdapat dua jenis sel utama yang dikenal sebagai sel primer dan sel sekunder. Artikel ini akan membahas tentang sel primer dan sel sekunder pada sel volta serta perbedaan antara keduanya dan bagaimana mereka berperan dalam menghasilkan energi listrik.
Pemanfaatan Sel Volta
Pemanfaatan sel elektrokimia dalam kehidupan sehari-hari adalah baterai (sumber arus searah). Sumber arus searah (DC) dipelopori oleh Luigi Galvani (1780) dan Aleassandro Volta (1800) melalui percobaannya yang dikenal sebagai sel volta. Sumber arus searah dapat dibagi menjadi 2, yaitu sel primer dan sel sekunder.
BACA: Praktikum Elektrokimia Sel Volta dan Sel Elektrolisis
Perbedaan antara sel primer dan sel sekunder adalah terletak pada kemampuan pengisian ulang energi listriknya. Pada sel primer energi listrik tidak dapat diisi ulang karena reaksinya bersifat tidak dapat balik (irreversible) sedangkan sebaliknya pada sel sekunder energi listrik dapat diisi ulang karena reaksinya bersifat dapat balik (reversible).
BACA: Perbedaan Sel Volta dan Sel Elektrolisis
Sel Primer
Sel volta primer adalah sel yang tidak dapat diisi ulang karena reaksinya tidak dapat balik (irreversible). Sel primer juga dikenal sebagai sel galvanik atau sel voltaik, yaitu salah satu jenis sel elektrokimia yang menghasilkan energi listrik secara langsung melalui reaksi kimia di dalamnya.
Bagian sel primer terdiri dari dua elektroda yang terbuat dari logam berbeda dan terendam dalam larutan elektrolit. Elektroda ini disebut elektroda anoda dan katoda. Pada elektroda anoda, terjadi reaksi oksidasi di mana atom logam mengalami oksidasi dan melepaskan elektron. Elektron ini kemudian mengalir melalui sirkuit eksternal ke elektroda katoda. Di elektroda katoda, terjadi reduksi, di mana pada reaksi ini, elektron yang telah mengalir dari anoda bereaksi dengan ion-ion yang ada dalam larutan elektrolit untuk membentuk senyawa. Proses ini melepaskan energi yang digunakan untuk menghasilkan arus listrik.
Contoh Sel Volta Primer
Contoh dari sel volta primer antara lain yaitu sel kering, sel alkaline, dan sel perak oksida. Berikut ini adalah 3 contoh sel primer beserta reaksi kimia yang terjadi:
1. Sel Kering (Sel Leclanche)
Sel kering terdiri dari katoda grafit dan anoda logam seng. Sel ini menggunakan elektrolit berbentuk pasta yang merupakan campuran MnO2 (pirolusit), NH4Cl, dan serbuk karbon. MnO2 bertindak sebagai oksidator, sedangkan NH4Cl sebagai reduktor dan pemberi suasana asam. Reaksi yang terjadi pada sel kering sebagai berikut:
Ion H+ pada katoda berasal dari hidrolisis NH4+:![]()
Amonia (NH3) yang dihasilkan bereaksi dengan Zn2+ pada reaksi berikutnya:
![]()
2. Sel Alkalin
Sel alkalin merupakan perbaikan dari sel kering, yaitu mengganti NH4Cl dengan pasta KOH. Penggantian tersebut mengakibatkan beda potensial yang dihasilkan akan relatif tetap dan meningkatkan masa pakai baterai. Anoda sel alkalin terbuat dari logam Zn dan katoda terbuat dari campuran MnO2 dengan KOH. Reaksi yang terjadi pada sel alkalin sebagai berikut:
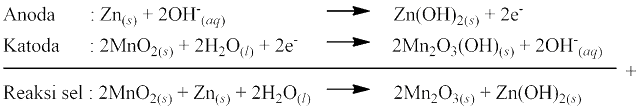
3. Sel Perak Oksida
Sel perak oksida banyak digunakan dalam jam tangan, kalkulator, dan perangkat elektronik kecil lainnya. Sel ini terdiri dari anoda logam Zn dan katoda oksida perak (Ag2O). Elektrolit yang digunakan berupa pasta yang mengandung KOH. Reaksi yang terjadi pada sel perak oksida sebagai berikut:
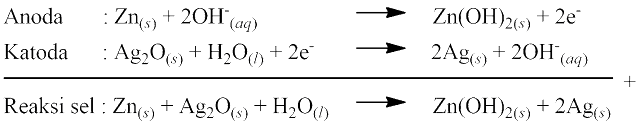
Nilai potensial sel yang dihasilkan sebesar 1,34 V.
Sel Sekunder
Sel volta sekunder merupakan sel yang dapat diisi kembali karena reaksinya dapat balik (reversible). Sel sekunder, juga dikenal sebagai sel elektrokimia reversibel atau sel akumulator, yaitu jenis sel elektrokimia yang dapat diisi ulang. Sel sekunder bekerja dengan mengubah energi listrik menjadi energi kimia saat diisi ulang dan mengubah energi kimia menjadi energi listrik saat digunakan.
Sel sekunder memiliki struktur yang mirip dengan sel primer, dengan dua elektroda dan larutan elektrolit. Namun, sel sekunder memiliki kemampuan untuk diisi ulang. Proses yang terjadi pada sel sekunder beroperasi dalam dua tahap, yaitu: pengisian dan pengosongan. Selama pengisian, energi listrik digunakan untuk membalikkan reaksi kimia yang terjadi selama pengosongan sehingga elektroda dapat dikembalikan ke keadaan semula. Reaksi kimia yang terjadi selama pengisian dan pengosongan sel sekunder melibatkan perubahan dalam keadaan elektroda dan larutan elektrolitnya. Salah satu contoh terkenal dari sel sekunder adalah baterai isi ulang (rechargeable battery), seperti baterai litium-ion yang digunakan dalam perangkat elektronik seperti ponsel, laptop, dan kendaraan listrik.
Contoh Sel Volta Sekunder
Contoh sel volta sekunder antara lain adalah sel aki, sel Ni-Cd, dan baterai litium. Berikut adalah 3 contoh aplikasi sel sekunder beserta dengan reaksi kimia yang terjadi.
1. Sel Aki
Sel aki disebut juga sebagai sel penyimpan karena dapat berfungsi sebagai penyimpan listrik yang dapat digunakan kapan saja. Sel aki terdiri dari anoda logam timbal (Pb) dan katoda logam timbal berlapis PbO2. Senyawa PbO2 berperan dalam reaksi reduksi-oksidasi (redoks). Elektrolit yang digunakan pada sel aki yaitu asam sulfat (H2SO4) 37%, yang sering disebut accu-zuur. Reaksi yang terjadi pada sel aki saat digunakan sebagai berikut:
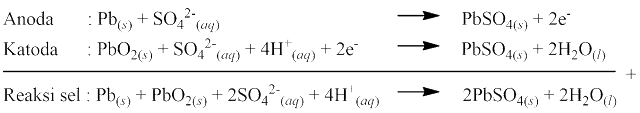
Reaksi sebaliknya terjadi saat sel aki sedang diisi:
![]()
Kandungan asam sulfat akan semakin menurun pada saat sel aki digunakan, sedangkan saat sel aki diisi kandungan asam sulfat akan meningkat.
2. Sel Nikel-Kadmium (Ni-Cd)
Sel Ni-Cd adalah sel kering yang dapat diisi ulang. Katode sel ini terbuat dari pasta Ni2O3, sedangkan anodanya terbuat dari Cd. Kadmium merupakan logam berat yang dapat mencemari lingkungan, sehingga penggunaan baterai jenis ini sudah semakin berkurang. Reaksi yang terjadi saat sel Ni-Cd digunakan adalah sebagai berikut:
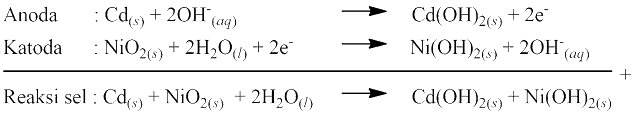
3. Baterai Litium
Baterai litium atau biasa disebut Li-on merupakan baterai yang banyak digunakan pada telepon seluler, laptop, tablet, dan perangkat elektronik lainnya. Baterai litium merupakan hasil nanoteknologi, ketika atom-atom Li ditaburkan pada lembaran grafit berukuran mikro yang membentuk molekul LixC6. Katodanya terbuat dari oksida logam litium yang terbentuk dari LiPF6 yang dilarutkan dalam pelarut organik dengan konsentrasi 1 M. Ion Li+ bergerak dari katoda ke anoda dan sebaliknya. Reaksi yang terjadi:
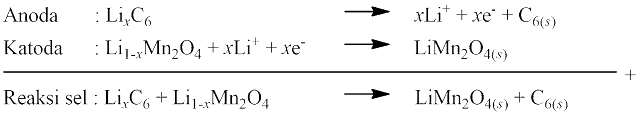
Apabila diisi ulang, reaksi akan berlangsung sebaliknya.
Perbedaan Sel Primer dan Sel Sekunder
Berikut ini adalah beberapa perbedaan antara sel primer dan sel sekunder secara umum:
- Sel primer menghasilkan energi listrik secara langsung melalui reaksi kimia, sedangkan sel sekunder dapat diisi ulang dan mengubah energi listrik menjadi energi kimia dan sebaliknya.
- Sel primer hanya dapat digunakan satu kali, sedangkan sel sekunder dapat diisi ulang dan digunakan berulang kali.
- Contoh sel primer termasuk sel perak oksida, sel alkalin dan sel kering sementara contoh sel sekunder termasuk baterai isi ulang seperti baterai litium-ion.
Kesimpulan
Dalam ringkasan, sel primer dan sel sekunder adalah dua jenis sel elektrokimia yang berperan dalam menghasilkan atau menyimpan energi listrik. Sel primer menghasilkan energi listrik secara langsung melalui reaksi kimia, sementara sel sekunder dapat diisi ulang dan digunakan berulang kali untuk mengonversi energi listrik menjadi energi kimia dan sebaliknya.


Posting Komentar untuk "3 Contoh Sel Primer dan Sel Sekunder Pada Sel Volta"