Laporan Praktikum Reaksi Nitrasi Pada Vanilin
Laporan praktikum reaksi nitrasi pada vanilin dari kalsium tetrahidrat Ca(NO3)2.4H2O dan vanilin (C8H8O3) menghasilkan senyawa aromatis yaitu nitrovanilin (C8H7NO5). Praktikum ini bertujuan untuk memahami reaksi nitrasi dan mempelajari mekanisme reaksi pada senyawa aromatis. Berikut laporan praktikum kimia organik reaksi nitrasi pada vanilin.
KIMIA ORGANIK
“REAKSI NITRASI PADA VANILIN”
A. Tujuan
Adapun tujuan dari praktikum ini yaitu sebagai berikut:
2. Memahami mekanisme reaksi pada senyawa aromatis
B. Dasar Teori
1. Senyawa Aromatik
Senyawa aromatik adalah golongan senyawa tidak jenuh dan cukup distabilkan oleh delokasi eloktron -pi. Senyawa aromatik yang paling banyak adalah benzena dan derivatnya (benzena tersubstitusi). Benzena mempunyai rumus molekul C6H6 dan termasuk ke dalam golongan senyawa hidrokarbon (Sitorus, 2010).
Benzena jika dibandingkan dengan senyawa hidrokarbon lain yang mengandung 6 buah atom karbon, misalnya heksana (C6H14) dan sikloheksana (C6H12), benzena mempunyai derajat ketidakjenuhan yang tinggi. Atas dasar dugaan tersebut maka dapat diperkirakan bahwa benzena memiliki ciri khas seperti yang dimiliki oleh alkena. Perkiraan tersebut ternyata jauh berbeda dengan kenyataannya karena benzena tidak dapat bereaksi seperti alkena (adisi, oksidasi, dan reduksi). Benzena tidak dapat bereaksi dengan HBr dan pereaksi-pereaksi lain yang lazimnya dapat bereaksi dengan alkena. Sifat-sifat kimia benzena menunjukkan bahwa benzena tidak segolongan dengan alkena ataupun sikloalkana (Hart, 1983).
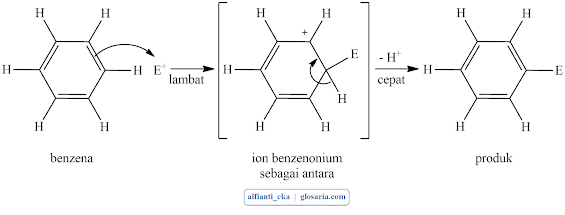
2. Reaksi Substitusi Aromatik Elektrofilik
Reaksi substitusi aromatik elektrofilik adalah reaksi dimana suatu elektrofil disubstitusikan untuk satu atom hidrogen pada cincin aromatik. Suatu elektrofil dapat menyerang elektron pi suatu cincin benzene untuk menghasilkan suatu macam karbokation yang terstabilkan oleh resonansi yang disebut suatu ion benzenonium. Seperti karbokation lain, suatu ion benzenonium bereaksi lebih lanjut. Sebuah ion hidrogen dibuang dari dalam zat antara (misalnya ditarik oleh HSO4-) untuk menghasilkan produk substitusi. Dalam menunjukkan struktur-struktur ini, digunakan rumus Kekule’ yang memungkinkan diikutinya jumlah elektron pi. Pada persamaan berikut, ditunjukkan juga atom-atom hidrogen yang terikat pada cincin, sehingga akan nampak pengaruh yang terjadi dalam reaksi.
3. Nitrasi
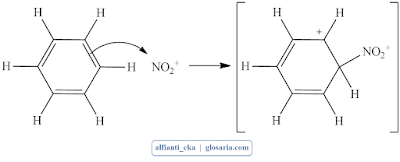
Benzena menjalani nitrasi bila diolah dengan HNO3 pekat. Katalis asam Lewis dalam reaksi ini adalah H2SO4 pekat. Seperti halnya halogenasi, nitrasi aromatik berupa dua tahap. Tahap pertama (tahap lambat) adalah serangan elektrofilik.
Tahap 1 (lambat)
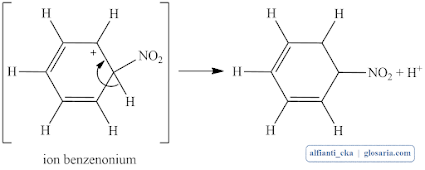
Hasil serangan ialah suatu ion benzenonium yang mengalami pelepasan H+ dengan cepat dalam tahap kedua
Tahap 2 (cepat)
Tahap ketiga dalam mekanisme reaksi ialah terbentuknya kembali katalis asam Lewis. Proton yang dilepaskan dalam Tahap 2 bereaksi dengan ion HSO4- membentuk H2SO4.
Tahap 3 (cepat)
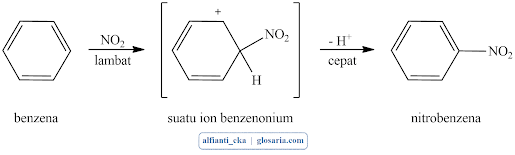
Dengan tidak mengikutsertakan katalis, persamaan keseluruhan reaksi nitrasi aromatik dari benzene dapat ditulis sebagai berikut:
(Fessenden dan Fessenden, 1986)
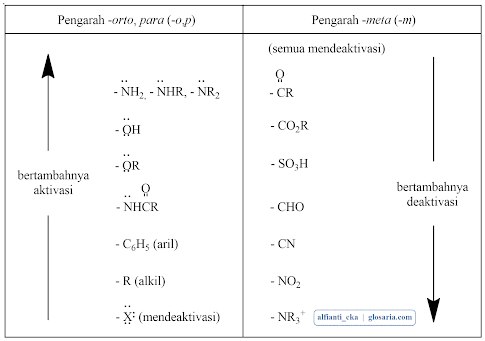
4. Gugus Aktivasi dan Gugus Deaktivasi
Gugus aktivasi ialah adanya gugus yang menyebabkan cincin lebih terbuka terhadap substitusi lebih lanjut seperti NH2. Gugus diaktivasi ialah gugus yang menyebabkan cincin lebih tertutup terhadap substitusi.
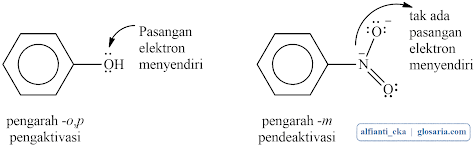
Tabel 1 meringkaskan substituent benzene yang sering dijumpai yang dikelompokkan sebagai gugus aktivasi atau diaktivasi dan sebagai pengarah -o, -p atau pengarah -m. semua pengarah -o, -p, kecuali halogen merupakan gugus aktivasi. Semua pengarah -m bersifat diaktivasi. Semua pengarah -o, -p kecuali gugus aril dan alkil, mempunyai pasangan elektron menyendiri pada atomnya yang terikat pada cincin. Tidak satupun dari pengarah -m memiliki pasangan elektron menyendiri pada atomnya yang terikat pada cincin.
(Fessenden dan Fessenden, 1986)
5. Nitrovanilin
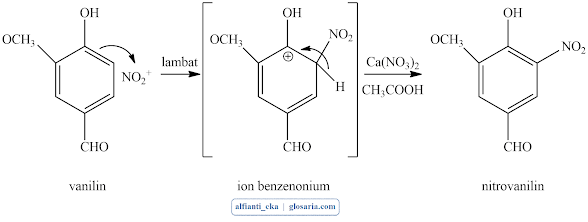
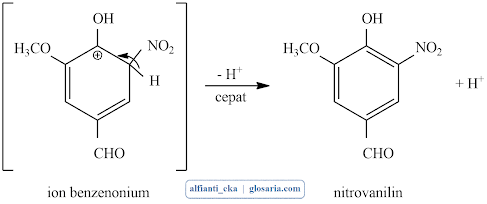
Vanilin (4-hidroksi-3-metoksi benzaldehid) merupakan senyawa aldehida aromatik yang penting. Pada awalnya vanilin diperoleh dari buah Vanilla planifolia. Nitrasi pada vanilin (nitrovanilin) adalah reaksi suatu elektrofil NO2+ akan disubstitusikan untuk satu atom hidrogen pada cincin aromatik pada vanilin. Reaksi yang terjadi sebagai berikut:
Nitovanilin (4-hidroksi-3-metoksi-5-nitrobenzaldehid) merupakan suatu produk berupa padatan berbentuk jarum berwarna kuning. Rumus kimia dari nitrovanilin yaitu C8H7NO5 dengan berat molekul 197,15 g/mol dan titik lelehnya 175-178 oC (Prabawati dan Wijayanto, 2015).
C. Alat dan Bahan
Alat yang digunakan pada percobaan ini adalah gelas arloji, gelas beaker 50 mL, gelas ukur 10 mL, pipet ukur 5 mL, bola hisap, penjepit gelas beaker, spatula, pinset, pengaduk kaca, penangas air, sendok sungu, termometer, kertas saring, aluminium foil, corong Buchner, statif dan klem, botol akuades, neraca analitik, hot plate, stopwatch, melting point apparatus, dan oven.
Bahan yang digunakan pada percobaan ini adalah vanilin, asam asetat, Ca(NO3)2.4H2O, air es, dan akuades.
D. Cara Kerja
Padatan Ca(NO3)2.4H2O sebanyak 1,5 gram dilarutkan ke dalam 5 mL asam asetat hangat. Setelah itu ditambahkan 1 gram vanilin. Campuran kemudian dipanaskan dalam penangas air pada suhu >80oC selama 1 menit. Selanjutnya campuran dimasukkan ke dalam 10 mL air es dan didinginkan di dalam kulkas selama 1,5 jam. Campuran yang telah didinginkan kemudian disaring menggunakan corong Buchner lalu padatannya dikeringkan di dalam oven. Setelah itu, produk yang dihasilkan diuji titik lelehnya dengan menggunakan melting point apparatus.
E. Data Hasil Pengamatan
|
No. |
Cara Kerja |
Pengamatan |
|
1. |
1,5 gram Ca(NO3)2.4H2O dilarutkan dalam 5 mL asam asetat hangat |
Massa Ca(NO3)2 = 1,5046 gram V asam asetat = 5 mL Larutan tidak berwarna dan larut |
|
2. |
Larutan ditambahkan dengan 1 gram vanilin |
Warna larutan berubah menjadi berwarna merah bata Massa vanilin = 1,0010 gram |
|
3. |
Campuran dipanaskan ke dalam penangas air dengan suhu 80 oC selama 1 menit |
Larutan menjadi sedikit keruh dan kental |
|
4. |
Campuran dituangkan ke dalam 10 mL air es dan didiamkan selama 1,5 jam dalam kulkas |
Timbul endapan berwarna coklat kekuningan dan larutannya berwarna kuning |
|
5. |
Campuran disaring menggunakan corong Buchner lalu padatan yang telah disaring dikeringkan di dalam oven |
Massa kertas saring = 0,3919 gram - Padatan yang tersaring berwarna kuning - Filtrat hasil penyaringan berwarna kuning - Setelah dikeringkan dalam oven padatan menjadi kering Massa nitrovanilin = 0,877 gram |
|
6. |
Rendemen |
69,835% |
|
7. |
Titik leleh diukur menggunakan melting point apparatus |
170 oC |
F. Pembahasan
Percobaan yang dilakukan berjudul Reaksi Nitrasi pada Vanilin. Tujuan dari percobaan ini adalah memahami reaksi nitrasi dan memahami mekanisme reaksi yang terjadi pada senyawa aromatis. Prinsip kerja pada percobaan ini adalah reaksi substitusi aromatik elektrofilik jenis reaksi nitrasi yaitu dimana suatu elektrofil NO2+ disubstitusikan untuk satu atom hidrogen pada cincin aromatik.
Langkah pertama yang dilakukan yaitu padatan Ca(NO3)2 dimasukkan ke dalam asam asetat hangat. Tujuannya adalah untuk menghasilkan elektrofilik.asam asetat bertindak sebagai katalis asam yang dapat mempercepat reaksi. Dalam reaksi ini yang bertindak sebagai elektrofilik dalam NO2+. Asam asetat mampu merebut gugus hidroksil dari Ca(NO3)2 sehingga menghasilkan elektrofilik NO2+. Persamaan reaksi yang terjadi:
Perlakuan selanjutnya yaitu penambahan vanilin menyebabkan larutan berubah warna menjadi merah bata. Peran vanilin pada percobaan ini adalah sebagai senyawa aromatis yang akan diserang oleh elektrofil NO2+ menghasilkan produk nitrovanilin.
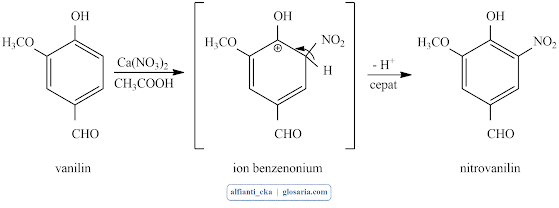
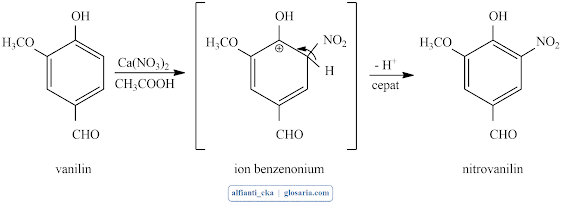
Perlakuan selanjutnya yaitu larutan dipanaskan dengan penangas air selama 1 menit dengan suhu >80 oC. penggunaan suhu di atas 80 oC sama dengan titik leleh dari vanilin. Vanilin akan larut sempurna apabila dipanaskan melewati suhu 80 oC. setelah itu campuran dimasukkan ke dalam air es. Pemindahan dilakukan dari suhu yang tinggi ke suhu yang rendah bertujuan untuk mempercepat proses kristalisasi membentuk senyawa nitrovanilin yang ditandai dengan adanya endapan berwarna coklat kekuningan pada larutan berwarna kuning. Kemudian larutan dimasukkan ke dalam kulkas selama 1,5 jam untuk membentuk endapan secara sempurna. Setelah itu larutan disaring menggunakan corong Buchner diperoleh padatan yang disaring berwarna kuning. Persamaan reaksi yang terjadi antara vanilin dan Ca(NO3)2.4H2O sebagai berikut:
Perlakuan selanjutnya yaitu pengeringan padatan yang telah disaring menggunakan oven selama kurang lebih 20 menit. Pengeringan dalam oven bertujuan untuk menguapkan seluruh pelarut hingga padatan yang dihasilkan kering sempurna. Kemudian, padatan yang telah dikeringkan ditimbang massanya dan diperoleh sebanyak 0,877 gram dengan rendemen sebesar 69,835%.
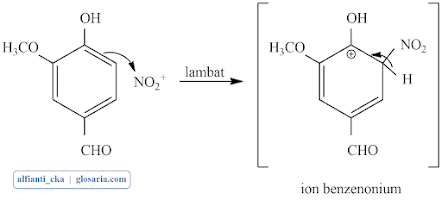
Perlakuan yang terakhir yaitu pengukuran titik leleh produk yang dihasilkan. Titik leleh produk diukur menggunakan melting point apparatus dan diperoleh titik leleh produk sebesar 170 oC. titik leleh yang diperoleh pada percobaan tidak sesuai dengan titik leleh secara teori yaitu 176-178 oC. hal ini dapat terjadi karena pada saat proses pendinginan dalam kulkas waktu yang digunakan kurang lama sehingga reaksi belum terjadi seluruhnya dan masih terdapat pengotor dalam produk yang dihasilkan menyebabkan ketidakmurnian yang diketahui dari titik lelehnya. Mekanisme reaksi yang terjadi sebagai berikut:
Tahap 1 (lambat): serangan elektrofilik
Tahap 2 (cepat): pelepasan H+ dengan cepat
Reaksi keseluruhan yang terjadi dari reaksi pada vanilin sebagai berikut:
G. Kesimpulan
Berdasarkan percobaan yang berjudul Reaksi Nitrasi pada Vanilin disimpulkan bahwa:
- Reaksi nitrasi adalah suatu proses kimia yang bertujuan untuk memasukkan gugus nitro ke dalam senyawa organik dalam percobaan ini yaitu pada vanilin. Rendemen yang dihasilkan sebesar 69,835% dengan titik leleh sebesar 170 oC.
- Mekanisme reaksi nitrasi pada senyawa aromatis dalam percobaan ini yaitu pembentukan nitrovanilin.
H. Daftar Pustaka
- Fessenden, R. J., dan Fessenden, J. S. 1986. Kimia Organik Jilid 2. Jakarta: Erlangga.
- Hart, H. 1983. Kimia Organik. Jakarta: Erlangga.
- Prabawati, S. Y., dan Wijayanto, A. 2015. Penerapan Green Chemistry dalam Praktikum Kimia Organik (Materi Reaksi Nitrasi Pada Benzena). Integrated Laboratory, 3: 1-8.
- Sitorus, M. 2010. Kimia Organik Umum. Yogyakarta: Graha Ilmu.
Lampiran
Perhitungan Reaksi Nitrasi Pada Vanilin
|
|
Ca(NO3)2 . 4H2O |
+ |
C8H8O3 |
-> |
C8H7NO5 |
+ |
Ca(OH)2 |
|
M |
0,006375 |
|
0,006585 |
|
- |
|
|
|
R |
0,006375 |
|
0,006375 |
|
0,006375 |
|
|
|
S |
- |
|
0,00021 |
|
0,006375 |
|
|


Posting Komentar untuk "Laporan Praktikum Reaksi Nitrasi Pada Vanilin"