Laporan Praktikum Elektrokimia: Sel Elektrolisis dan Sel Volta
Glosaria.com - Percobaan berjudul Praktikum Elektrokimia: Elektrolisis dan Sel Volta. Tujuan dari percobaan ini yaitu untuk memahami yang dimaksud dengan reaksi redoks dan aplikasinya pada proses sel elektrolisis dan sel volta, memahami perbedaan sel elektrolisis dan sel volta/galvani, dan dapat merangkai sel elektrolisis sederhana dan menggunakannya. Percobaan ini menggunakan prinsip analisis kualitatif karena hanya mengamati perubahan yang terjadi pada larutan dan elektroda.
“ELEKTROKIMIA: ELEKTROLISIS DAN SEL VOLTA”
A. Tujuan
- Memahami yang dimaksud dengan reaksi redoks dan aplikasinya pada proses elektrolisis dan sel volta.
- Memahami perbedaan sel elektrolisis dan sel volta atau Galvani.
- Dapat merangkai sel elektrolisis sederhana dan menggunakannya.
B. Dasar Teori
1. Elektrokimia
Elektrokimia adalah cabang ilmu yang mempelajari interkonversi energi listrik dan energi kimia. Proses elektrokimia adalah reaksi redoks (reduksi-oksidasi) dimana dalam reaksi ini energi yang dilepas oleh reaksi spontan diubah menjadi listrik atau dimana energi listrik digunakan agar reaksi yang non spontan bisa terjadi (Chang, 2004).
2. Reaksi Reduksi Oksidasi (Redoks)
Reaksi redoks melibatkan perubahan dalam keadaan oksidasi pereaksi-pereaksi. Dalam contoh sederhana terdapat kehilangan elektron oleh pereaksi lain. Bila aliran elektron yang menyertai suatu reaksi membentuk arus listrik, maka perubahan kimia itu dirujuk sebagai elektrokimia (Keenan, 1992).
Elektrokimia sangat identik dengan reaksi redoks yaitu reaksi yang menghasilkan serah terima elektron secara langsung dari satu partikel ke partikel lainnya. Di dalam reaksi redoks, terdapat konduktor dan isolator. Logam dan larutan elektrolit bertindak sebagai konduktor karena logam tembaga terdapat banyak elektron bebas yang dapat berpindah dari satu atom ke atom yang lain. Sedangkan larutan elektrolit dapat bertindak sebagai konduktor karena mengandung partikel bermuatan yang disebut ion positif dan ion negatif. Ion positif akan bergerak ke elektroda negatif (katoda) dan ion negatif ke elektroda positif (anoda) (Syukri, 1999).
Dalam reaksi redoks selalu terjadi bersamaan. Oksidasi ditandai dengan hilangnya elektron, sedangkan reduksi ditandai dengan penangkapan elektron. Oksidasi sebagai peningkatan bilangan oksidasi dan reduksi sebagai penurunan bilangan oksidasi. Reaksi redoks dapat terjadi dalam satu wadah, sehingga serah terima elektron terjadi secara langsung dari sati partikel ke partikel yang lain. Dalam elektrokimia, serah terima elektron dibuat secara tidak langsung yaitu melalui kawat atau logam. Reaksi non redoks merupakan reaksi yang tidak menggunakan oksidasi-reduksi antar zatnya, sehingga tidak ada pertukaran elektron di dalamnya (Vogel, 1979).
3. Sel Volta
Sel volta merupakan penataan bahan kimia dan penghantar listrik yang memberikan aliran elektron lewat rangkaian listrik dari suatu zat kimia yang teroksidasi ke zat kimia yang direduksi. Dalam sel volta, oksidasi berarti dilepaskannya elektron oleh atom-atom, molekul, ataupun ion. Reduksi berarti diperolehnya elektron oleh partikel-partikel tersebut. Prinsip-prinsip sel volta/sel galvani antara lain:
- a. Terjadi perubahan energi kimia menjadi energi listrik
- b. Pada anoda, elektron adalah produk dari reaksi oksidasi.
- c. Pada katoda, elektron adalah reaktan dari reaksi reduksi.
- d. Arus elektron mengalir dari anoda ke katoda.
- e. Arus listrik mengalir dari katoda ke anoda.
- f. Jembatan garam menyetimbangkan ion-ion dalam larutan.
Fungsi dari jembatan garam adalah untuk menetralkan kelebihan anion dan kation pada larutan dan untuk menutupi rangkaian sehingga reaksi dapat berlangsung terus menerus (Keenan, 1992)
Sel volta atau sel Galvani dapat digunakan untuk menentukan arah kespontanan reaksi redoks, hasil kali kelarutan, konstanta kesetimbangan dan menentukan pH larutan. Namun sel ini juga dapat menimbulkan korosi. Korosi merupakan reaksi antara logam dengan zat lain yang menyeluruh permukaannya sehingga membentuk oksidasi logam. Korosi termasuk reaksi redoks dan prosesnya merupakan proses sel volta/Galvani (Syukri, 1999).
- Pengertian Sel Volta, Susunan dan Notasi Sel Volta
- 3 Contoh Sel Primer dan Sel Sekunder Pada Sel Volta
4. Sel Elektrolisis
Sel elektrolisis merupakan sel elektrokimia yang menggunakan energi listrik untuk menjadikan reaksi kimia. Rangkaian elektrolisis yang menjadikan terjadinya reaksi kimia akibat dialiri listrik, pada sel elektrolisis, katoda merupakan kutub negatif, sedangkan anoda merupakan kutub positif. Sel elektrolisis memerlukan energi untuk memompa elektron dam prosesnya berkebalikan dengan sel volta. Dalam sel ini, haru ada ion, molekul, ataupun atom yang dapat menerima elektron dan melepas elektron. Reaksi elektrolisis adalah reaksi redoks yang tidak spontan, tetapi terjadi karena dialiri arus listrik (Vogel, 1979).
BACA: Sel Elektrolisis: Pengertian, Komponen, Reaksi Elektrolisis dan Contoh Aplikasinya
Prinsip dasar dari sel elektrolisis didasarkan pada rasio tegangan antara zat yang memiliki kemampuan untuk bereaksi dengan zat lain/ terjadi persaingan antara beberapa kation dengan air sebagai pelarut untuk tereduksi. Yang berpotensial reduksi lebih besar dan pada anoda yang menang adalah yang berpotensial oksidasi besar (Syukri, 1999).
Berdasarkan keadaan ion dalam wadahnya, elektrolisis dibagi menjadi dua antara lain:
a. Elektrolisis lelehan senyawa ion
Senyawa ion dapat dielektrolisis dalam keadaan cair ataupun larutan. Senyawa ion berwujud padat tidak dapat dielektrolisis karena tidak mengandung ion bebas. Akan tetapi ketika dipanaskan sampai meleleh (cair) akan terurai menjadi ion-ion:
My → Mn+ + yn-
Ion positif (kation) tertarik ke katoda dan ion negatif (anion) ke anoda. Ion logam baik golongan utama maupun transisi bertindak sebagai kation. Monoaton dan poliatom bertindak sebagai anion. Tetapi anion yang sering digunakan adalah monoatom karena mudah melepas elektronnya.
b. Elektrolisis larutan
Elektroda inert tidak akan bereaksi pada elektrolisis larutan, namun bila larutan mengandung ion alkali, alkali tanah, ion aluminium, maupun ion mangan (II) maka air akan mengalami reduksi di katoda. Bila larutan mengandung ion sulfat, nitrat dan ion sisa asam oksi maka air akan mengalami oksidasi di anoda (Syukri, 1999).
- Penggunaan Sel Elektrolisis Dalam Industri dan Kehidupan Sehari-hari
- Perbedaan Sel Volta dan Sel Elektrolisis Beserta Contohnya
C. Alat dan Bahan
Alat-alat yang digunakan pada percobaan ini adalah gelas beaker 50 mL, gelas arloji, pengaduk gelas, multimeter, adaptor, penjepit buaya, paku baja/besi, batang karbon, batang tembaga, bola lampu, lampu led, kabel, sendok sungu, dan botol akuades. Bahan-bahan yang digunakan pada percobaan ini adalah larutan air, sofa kue, MSG, garam dapur, batu baterai, dan akuades.
D. Cara Kerja
Percobaan pertama yaitu pembuatan rangkaian listrik. Kabel, baterai, dan lampu dirangkai dengan sedemikian rupa. Percobaan kedua yaitu pembuatan sel elektrolisis. Adaptor, multi meter, kabel, penjepit buaya, dan elektroda (Fe, C, dan Cu) dirangkai membentuk sel elektrolisis. Kemudian dilakukan proses elektrolisis menggunakan akuades, air keran, larutan soda kue, larutan NaCl, dan larutan MSG. kemudian diamati perubahan pada larutan dan diukur beras arus listrik dan tegangan yang dihasilkan. Setelah itu diulangi dengan elektroda yang berbeda.
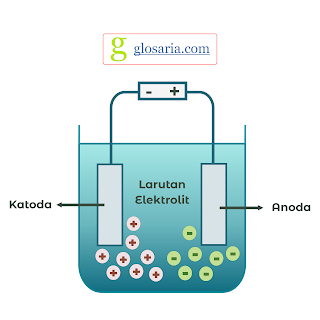 |
| Sel Elektrolisis |
E. Data Hasil Pengamatan
|
No. |
Elektroda |
Larutan |
Hasil Pengamatan |
Tegangan Arus |
||
|
Katoda |
Anoda |
Katoda |
Anoda |
|||
|
1. |
Fe |
Fe |
Akuades |
- |
- |
V600 = 0,18 A |
|
2. |
Fe |
Fe |
Air |
- |
- |
V600 = 0,18 A |
|
3. |
Fe |
Fe |
NaHCO3 |
- |
- |
V600 = 0,18 A |
|
4. |
Fe |
Fe |
MSG |
- |
- |
V600 = 0,18 A |
|
5. |
Fe |
Fe |
NaCl |
- |
- |
V600 = 0,19 A |
|
6. |
C |
C |
Akuades |
Sedikit gelembung |
Sedikit gelembung |
V600 = 0,17 A |
|
7. |
C |
C |
Air |
Banyak gelembung |
Sedikit gelembung |
V600 = 0,19 A |
|
8. |
C |
C |
NaHCO3 |
Sedikit gelembung |
- |
V600 = 0,19 A |
|
9. |
C |
C |
MSG |
Banyak gelembung |
Sedikit gelembung |
V600 = 0,19 A |
|
10. |
C |
C |
NaCl |
Banyak gelembung |
Sedikit gelembung |
V600 = 0,19 A |
|
11. |
Cu |
Cu |
Akuades |
- |
- |
V600 = 0,19 A |
|
12. |
Cu |
Cu |
Air |
- |
- |
V600 = 0,19 A |
|
13. |
Cu |
Cu |
NaHCO3 |
- |
- |
V600 = 0 A |
|
14. |
Cu |
Cu |
MSG |
- |
- |
V600 = 0,19 A |
|
15. |
Cu |
Cu |
NaCl |
- |
- |
V600 = 0 A |
F. Pembahasan
Percobaan yang dilakukan berjudul Elektrokimia: Elektrolisis dan Sel Volta. Tujuan dari praktikum ini yaitu untuk memahami yang dimaksud dengan reaksi redoks dan aplikasinya pada proses sel elektrolisis dan sel volta, memahami perbedaan sel elektrolisis dan sel volta/galvani, dan dapat merangkai sel elektrolisis sederhana dan menggunakannya. Percobaan ini menggunakan prinsip analisis kualitatif karena hanya mengamati perubahan yang terjadi pada larutan dan elektroda.
Percobaan ini menggunakan reaksi redoks yaitu reaksi yang prosesnya terjadi serah terima elektron antar zat. Reaksi redoks digunakan dalam proses elektrolisis dan sel volta. Pada sel elektrolisis, reaksi redoks akan terbentuk dari sepasang elektroda yang dimasukkan ke dalam larutan elektrolit. Tujuannya untuk mengendapkan logam dan mengumpulkan gelembung udara yang muncul di dekat elektroda. Pada sel volta, reaksi redoks berperan untuk menghasilkan arus atau energi listrik.
Percobban pertama membuat rangkaian listrik yaitu rangkaian yang mengubah energi kimia menjadi energi listrik. Energi kimia yang dimaksud adalah baterai yang digunakan. Baterai terdapat reaksi kimia yang ketika dihubungkan dengan kabel dan lampu maka lampu tersebut akan menyala. Lampu yang menyala membuktikan bahwa adanya perubahan yang terjadi dari energi kimia menjadi energi listrik.
Baterai adalah sel galvani atau beberapa sel galvani yang disatukan yang dapat digunakan sebagai sumber arus listrik searah pada sel volta tetap. Baterai sel kering yaitu sel tanpa komponen cairan, yang paling umum adalah sel lechanche yang digunakan lampu senter. Anoda selnya terbuat dari sebuah kaleng atau wadah seng yang bersentuhan dengan mangan dioksida (MnO2) dan sebuah elektrolit. Elektrolit ini terdiri atas ammonium klorida dan seng klorida dalam air. Sebatang kerbon berfungsi sebagai katoda yang direndam di dalam elektrolit ini pada bagian tengah dari selnya. Reaksi yang terjadi sebagai berikut:
Anoda : Zn(s) → Zn2+(aq)
+ 2e-
Katoda : 2NH4+(aq)
+ 2MnO4(s) + 2e- → Mn2O3(s) + 2NH3(aq)
+ H2O(l)
Hasil : Zn(s) + 2NH4+(aq)
+ 2MnO4(s) →
Zn2+(aq) + Mn2O3(s) +
2NH3(aq) + H2O(l)
Persamaan tersebut merupakan bentuk yang sangat sederhana dari suatu proses yang rumit. Voltase yang dihasilkan oleh sel kering sekitar 1,5 V.
Percobaan kedua yaitu sel elektrolisis, langkah pertama yaitu merangkai alat-alat yang digunakan. Elektroda yang digunakan antara lain besi (Fe), tembaga (Cu), dan karbon (C). larutan yang digunakan yaitu akuades, soda kue, garam dapur, MSG, dan air keran.
Perlakuan pertama menggunakan akuades sebagai larutan yang akan dielektrolisis. Akuades disiapkan dalam gelas beaker lalu dimasukkan elektroda. Elektroda yang pertama digunakan adalah Fe. Secara teori, akuades tidak terionisasi karena akuades dibentuk berdasarkan ikatan kovalen antar atom hidrogen dan oksigen. Hasil percobaan menunjukkan tidak adanya gelembung udara yang dihasilkan baik di katoda maupun di anoda. Hal ini terjadi jika elektroda diganti dengan Fe dan Cu. Pada elektroda C menghasilkan sedikit gelembung. Hal ini menunjukkan bahwa sel elektrolisis membutuhkan energi listrik untuk reaksi redoks. Reaksi yang terjadi pada elektrolisis akuades sebagai berikut:
· Akuades dengan elektroda Fe
H2O(l) →
· Akuades dengan elektroda Cu
H2O(l) →
· Akuades dengan elektroda C
Katoda : 2H2O(l)
+ 2e- →
2OH-(aq) + H2(g) x2
Anoda : 4OH-(aq)
→ 2H2O(l)
+ O2(g) + 4e- x1
Katoda : 4H2O(l)
+ 4e- → 4OH-(aq)
+ 2H2(g)
Anoda : 4OH-(aq)
→
2H2O(l) + O2(g) + 4e-
Hasil : 2H2O(l)
→ 2H2(g) + O2(g)
Perlakuan kedua menggunakan air keran sebagai larutan yang akan dielektrolisis. Dalam C menghasilkan gelembung pada katoda dan anoda meskipun lebih banyak gelembung yang dihasilkan pada katoda. Secara teori, hasil antara Fe dan Cu yaitu reduksi terjadi pada air menghasilkan gas H2 dan oksidasi hanya menghasilkan ion-ion elektroda yaitu Cu2+ dan Fe2+. Reaksi yang terjadi pada elektrolisis air keran sebagai berikut:
· Air keran dengan elektroda Fe
Katoda : 2H2O(l)
+ 2e- → 2OH-(aq)
+ H2(g)
Anoda : Fe(s)
→ Fe2+(aq)
+ 2e-
Hasil : Fe(s) + 2H2O(l)
→ Fe2+(aq) + 2OH-(aq)
+ H2(g)
· Air keran dengan elektroda Cu
Katoda : 2H2O(l)
+ 2e- → 2OH-(aq)
+ H2(g)
Anoda : Cu(s) →
Cu2+(aq) + 2e-
Hasil : Cu(s) + 2H2O(l)
→ Cu2+(aq) + 2OH-(aq)
+ H2(g)
· Air keran dengan elektroda C
Katoda : 2H2O(l)
+ 2e- → 2OH-(aq)
+ H2(g) x2
Anoda : 2H2O(l)
→ 4H+(aq)
+ O2(g) + 4e- x1
Katoda : 4H2O(l)
+ 4e- → 4OH-(aq)
+ 2H2(g)
Anoda : 2H2O(l)
→ 4H+(aq) + O2(g)
+ 4e-
Hasil : 6H2O(l)
→ 4H+(aq) + O2(g)
+ 4OH-(aq) + 2H2(g)
Perlakuan ketiga yaitu menggunakan larutan soda kue. Larutan soda kue yang dielektrolisis menggunakan elektroda C secara teori dinyatakan bahwa pada anoda terdapat gelembung saat terjadi reaksi redoks. Namun hasil yang didapatkan tidak terdapat gelembung pada anoda. Begitu pula dengan elektroda Fe dan Cu tidak menghasilkan perubahan. Hal ini tidak sesuai dengan teori dikarenakan alat yang digunakan saat praktikum ternyata belum dialiri arus listrik karena sambungan kabel yang terputus. Sehingga saat alat telah diperbaiki arus listrik masih belum teratur dengan sempurna. Reaksi yang terjadi pada elektrolisis soda kue sebagai berikut:
· Larutan
soda kue dengan elektroda Fe
Katoda : 2H2O(l)
+ 2e- → 2OH-(aq)
+ H2(g)
Anoda : Fe(s) → Fe2+(aq)
+ 2e-
Hasil : Fe(s) + 2H2O(l)
→ Fe2+(aq)
+ 2OH-(aq) + H2(g)
· Larutan
soda kue dengan elektroda Cu
Katoda : 2H2O(l)
+ 2e- → 2OH-(aq)
+ H2(g)
Anoda : Cu(s) → Cu2+(aq)
+ 2e-
Hasil : Cu(s) + 2H2O(l)
→ Cu2+(aq)
+ 2OH-(aq) + H2(g)
· Larutan soda kue dengan elektroda C
Katoda : 2H2O(l)
+ 2e- → 2OH-(aq)
+ H2(g) x2
Anoda : 2H2O(l)
→ 4H+(aq)
+ O2(g) + 4e- x1
Katoda : 4H2O(l)
+ 4e- → 4OH-(aq)
+ 2H2(g)
Anoda : 2H2O(l)
→ 4H+(aq)
+ O2(g) + 4e-
Hasil : 6H2O(l)
→ 4H+(aq)
+ O2(g) + 4OH-(aq) + 2H2(g)
Perlakuan keempat yaitu menggunakan larutan MSG. Langkah pertama yang dilakukan yaitu dengan elektroda C menghasilkan gelembung pada kedua batang elektrodanya. Hal tersebut dikarenakan gas H2 yang timbul di katoda dan anoda karena reaksi redoks. Selanjutnya elektroda diganti dengan Fe dan Cu tidak menghasilkan perubahan apapun. Hal ini tidak sesuai dengan teori karena alat yang digunakan tidak berfungsi dengan baik. Reaksi yang terjadi pada elektrolisis larutan MSG sebagai berikut:
· Larutan
MSG dengan elektroda Fe
Katoda : 2H2O(l)
+ 2e- → 2OH-(aq)
+ H2(g)
Anoda : Fe(s) → Fe2+(aq)
+ 2e-
Hasil : Fe(s) + 2H2O(l)
→ Fe2+(aq)
+ 2OH-(aq) + H2(g)
· Larutan
MSG dengan elektroda Cu
Katoda : 2H2O(l)
+ 2e- → 2OH-(aq)
+ H2(g)
Anoda : Cu(s) → Cu2+(aq)
+ 2e-
Hasil : Cu(s) + 2H2O(l)
→ Cu2+(aq)
+ 2OH-(aq) + H2(g)
· Larutan MSG dengan elektroda C
Katoda : 2H2O(l)
+ 2e- → 2OH-(aq)
+ H2(g) x2
Anoda : 2H2O(l)
→ 4H+(aq)
+ O2(g) + 4e- x1
Katoda : 4H2O(l)
+ 4e- → 4OH-(aq)
+ 2H2(g)
Anoda : 2H2O(l)
→ 4H+(aq)
+ O2(g) + 4e-
Hasil : 6H2O(l)
→ 4H+(aq)
+ O2(g) + 4OH-(aq) + 2H2(g)
Perlakuan kelima yaitu menggunakan NaCl. Elektroda C dimasukkan ke dalam larutan. Katoda menghasilkan gelembung lebih banyak karena koefisien H pada H2O yang lebih banyak daripada ion Cl- menjadi Cl2. Reaksi yang terjadi pada elektrolisis larutan garam dapur sebagai berikut:
· Larutan
NaCl dengan elektroda Fe
Katoda : 2H2O(l)
+ 2e- → 2OH-(aq)
+ H2(g)
Anoda : Fe(s) → Fe2+(aq)
+ 2e-
Hasil : Fe(s) + 2H2O(l)
→ Fe2+(aq)
+ 2OH-(aq) + H2(g)
· Larutan
MSG dengan elektroda Cu
Katoda : 2H2O(l)
+ 2e- → 2OH-(aq)
+ H2(g)
Anoda : Cu(s) → Cu2+(aq)
+ 2e-
Hasil : Cu(s) + 2H2O(l)
→ Cu2+(aq)
+ 2OH-(aq) + H2(g)
· Larutan MSG dengan elektroda C
Katoda : 2H2O(l)
+ 2e- → 2OH-(aq)
+ H2(g)
Anoda : 2Cl-(s)
→ Cl2(aq)
+ 2e-
Hasil : 2Cl-(s)
+ 2H2O(l) →
Cl2(aq) + 2OH-(aq) + H2(g)
Penggunaan arus listrik dan pengukuran tegangan dalam reaksi dilakukan untuk membuktikan bahwa di dalam sell elektrolisis membutuhkan energi listrik untuk melakukan reaksi kimia.
G. Kesimpulan
Berdasarkan percobaan Elektrokimia: Elektrolisis dan Sel Volta dapat disimpulkan bahwa:
- Reaksi redoks adalah proses elektrokimia yang menyebabkan serah terima elektron di dalam prosesnya, sehingga di dalam reaksi terjadi proses oksidasi oleh reduktor dan reduksi oleh oksidator. Energi yang dilepas reaksi spontan diubah menjadi listrik. Reaksi dapat berjalan di dalam sel volta dan sel elektrolisis jika terdapat elektroda dan elektrolitnya. Reaksi digunakan untuk batu baterai dalam sel volta dan elektrolisis.
- Sel elektrolisis dan sel volta dibedakan dari perubahan energinya. Dimana sel elektrolisis menggunakan energi listrik untuk menghasilkan reaksi redoks, sedangkan sel volta menggunakan reaksi kimia (redoks) untuk menghasilkan energi listrik.
- Rangkaian sel elektrolisis sederhana:
 |
| Sel Elektrolisis |
H. Daftar Pustaka
- Chang, R. 2004. Kimia Dasar: Konsep-konsep Inti Jilid 2. Jakarta: Erlangga.
- Keenan, W. 1992. Kimia Untuk Universitas Jilid 1. Jakarta: Erlangga.
- Syukri, S. 1999. Kimia Dasar 1. Bandung: ITB.
- Vogel. 1979. Kimia Dasar. Bandung: Remaja Karya.

Posting Komentar untuk "Laporan Praktikum Elektrokimia: Sel Elektrolisis dan Sel Volta"