Sel Elektrolisis: Pengertian, Komponen, Reaksi Elektrolisis dan Contoh Aplikasinya
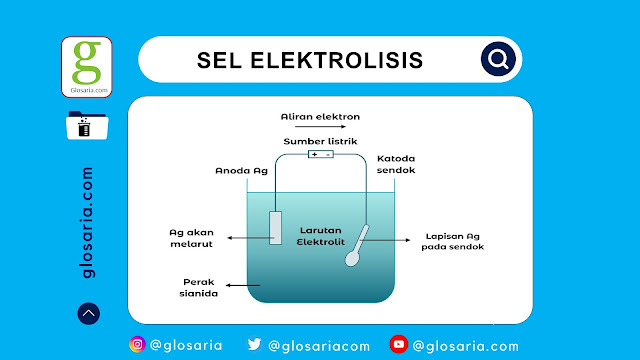 |
| Penyepuhan sel elektrolisis |
Glosaria.com - Sel elektrolisis merupakan salah satu jenis sel elektrokimia yang menggunakan energi listrik untuk mendorong terjadinya reaksi kimia yaitu reaksi redoks yang tidak spontan. Komponen sel elektrolisis tersusun dari dua buah elektroda (anoda dan katoda) yang dihubungkan dan dialirkan sumber listrik di mana elektroda ini akan dimasukkan dalam suatu larutan elektrolit.
Sel elektrolisis ini banyak digunakan dalam industri kimia, metalurgi, kerajinan dan sebagainya. Bagaimana proses elektrolisis ini dapat terjadi dalam suatu larutan elektrolit? Berikut artikel selengkapnya.
Sel Elektrokimia
Pada dasarnya, sel elektrokimia terdiri dari dua jenis sel, yaitu sel elektrolisis dan sel volta. Kedua sel ini memiliki tujuan yang berbeda, jika pada sel volta reaksi kimia dimanfaatkan untuk menghasilkan energi listrik, sebaliknya pada sel elektrolisis membutuhkan energi listrik agar reaksi tidak spontan dapat berlangsung.
BACA: Perbedaan Sel Volta dan Sel Elektrolisis
Elektrolisis adalah proses penguraian suatu elektrolit oleh arus listrik pada sel elektrolisis. Reaksi kimia akan terjadi jika arus listrik dialirkan melalui larutan elektrolit, yaitu energi listrik (arus listrik) diubah menjadi energi kimia (reaksi redoks). Elektrolit adalah zat yang dapat menghantarkan listrik karena mengandung ion-ion bebas.
Pengertian Elektrolisis
Kata "elektrolisis" berasal dari bahasa Yunani, yaitu "elektron" yang berarti "logam" dan "lysis" yang berarti "penguraian". Jadi, dapat disimpulkan bahawa elektrolisis adalah proses penguraian suatu elektrolit oleh arus listrik. Elektrolit adalah zat yang dapat menghantarkan listrik, hal ini karena pada larutan elektrolit mengandung ion-ion bebas.
Sel elektrolisis adalah sel elektrokimia yang menggunakan listrik untuk mendorong reaksi redoks tidak spontan. Sel elektrolisis terdiri dari dua elektroda yang dihubungkan pada sumber listrik. Elektroda yang disambungkan ke kutub positif disebut anoda, sedangkan elektroda yang disambungkan ke kutub negatif disebut katoda.
Proses Elektrolisis
Bagaimana proses yang terjadi dalam sel elektrolisis? Seperti yang sudah kita ketahui sebelumnya, sel elektrolisis terdiri dari dua elektroda yang dihubungkan pada sumber listrik, yaitu anoda dan katoda. Anoda adalah elektroda yang disambungkan ke kutub positif, sedangkan katoda adalah elektroda yang disambungkan ke kutub negatif disebut katoda.
Pada sel elektrolisis, ion-ion dalam elektrolit akan bergerak menuju elektroda yang berlawanan muatan. Ion positif (kation) akan bergerak menuju katoda, sedangkan ion negatif (anion) akan bergerak menuju anoda.
Pada katoda, kation akan mengalami reaksi reduksi, yaitu menerima elektron dari sumber listrik. Pada anoda, anion akan mengalami reaksi oksidasi, yaitu melepaskan elektron ke sumber listrik. Itulah yang menjadi beberapa ciri-ciri dari sel elektrolisis.
 |
| Susunan Sel Elektrokimia |
Komponen Sel Elektrolisis
Secara umum, komponen sel elektrolisis terdiri dari elektroda, larutan elektrolit dan sumber listrik. Berikut adalah komponen-komponen dalam sel elektrolisis:
1. Elektroda
Elektroda adalah bagian dari sel elektrolisis yang terhubung ke sumber listrik. Elektroda terdiri dari dua jenis, yaitu katoda dan anoda. Katoda adalah elektroda yang dihubungkan ke kutub negatif sumber listrik, sedangkan anoda adalah elektroda yang dihubungkan ke kutub positif sumber listrik.
2. Larutan elektrolit
Larutan elektrolit adalah zat yang dapat menghantarkan listrik karena mengandung ion-ion bebas. Larutan elektrolit yang digunakan dalam sel elektrolisis dapat berupa larutan, lelehan, atau gas.
3. Sumber listrik
Sumber listrik adalah bagian dari sel elektrolisis yang menyuplai arus listrik. Sumber listrik dapat berupa baterai, generator, atau transformator.
Susunan Sel Elektrolisis
Pada dasarnya, susunan sel elektrolisis terdiri dari dua elektroda yang dihubungkan pada sumber listrik, larutan elektrolit, dan sumber listrik. Ion-ion dalam larutan elektrolit akan bergerak menuju elektroda yang berlawanan muatan. Pada katoda, kation akan mengalami reaksi reduksi, sedangkan pada anoda, anion akan mengalami reaksi oksidasi.
Secara garis besar, susunan sel elektrolisis dapat digambarkan sebagai berikut:
anoda | larutan elektrolit | katoda
Pada sel elektrolisis, ion-ion dalam larutan elektrolit akan bergerak menuju elektroda yang berlawanan muatan. Ion positif (kation) akan bergerak menuju katoda, sedangkan ion negatif (anion) akan bergerak menuju anoda.
Pada katoda, kation akan mengalami reaksi reduksi, yaitu menerima elektron dari sumber listrik. Pada anoda, anion akan mengalami reaksi oksidasi, yaitu melepaskan elektron ke sumber listrik.
Reaksi Elektrolisis
Pada sel elektrolisis, ion-ion dalam elektrolit akan bergerak menuju elektroda yang berlawanan muatan. Ion positif (kation) akan bergerak menuju katoda, sedangkan ion negatif (anion) akan bergerak menuju anoda.
Reaksi yang bekerja pada sel elektrolisis adalah reaksi tidak spontan. Reaksi pada sel elektrolisis terdiri dari reaksi reduksi dan reaksi oksidasi.
Pada katoda, kation akan mengalami reaksi reduksi, yaitu menerima elektron dari sumber listrik. Pada anoda, anion akan mengalami reaksi oksidasi, yaitu melepaskan elektron ke sumber listrik.
Reaksi elektrolisis dapat digambarkan sebagai berikut:
Reaksi Reduksi
Reaksi reduksi adalah reaksi kimia yang melibatkan penangkapan elektron. Pada reaksi reduksi, suatu zat mengalami penurunan bilangan oksidasi.
Pada elektrolisis, reaksi reduksi terjadi pada katoda. Ion positif (kation) akan menerima elektron dari sumber listrik dan mengalami reaksi reduksi.
Reaksi Oksidasi
Reaksi oksidasi adalah reaksi kimia yang melibatkan pelepasan elektron. Pada reaksi oksidasi, suatu zat mengalami kenaikan bilangan oksidasi.
Pada elektrolisis, reaksi oksidasi terjadi pada anoda. Ion negatif (anion) akan melepaskan elektron ke sumber listrik dan mengalami reaksi oksidasi.
Contoh Reaksi Sel Elektrolisis
Reaksi elektrolisis memiliki banyak kegunaan, antara lain pada pembuatan logam, pembuatan gas, pembuatan bahan kimia, pembuatan coating, dan pembuatan sel baterai.
Berikut adalah beberapa contoh reaksi yang terjadi pada sel elektrolisis:
1. Elektrolisis larutan tembaga sulfat (CuSO4)
Pada elektrolisis larutan tembaga sulfat, ion tembaga (Cu2+) akan mengalami reaksi reduksi di katoda dan menjadi tembaga (Cu). Ion sulfat (SO42-) akan mengalami reaksi oksidasi di anoda dan menjadi gas belerang (S2).
Reaksi yang terjadi pada elektrolisis larutan CuSO4 dapat digambarkan sebagai berikut:
Cu2+ (aq) + 2e- → Cu (s)
SO42- (aq) → S2 (g) + 2e-
2. Elektrolisis air (H2O)
Elektrolisis air adalah salah satu sel elektrolisis yang menghasilkan gas oksigen dan gas hidrogen. Pada elektrolisis air, ion hidrogen (H+) akan mengalami reaksi reduksi di katoda dan menjadi gas hidrogen (H2). Ion oksigen (O2-) akan mengalami reaksi oksidasi di anoda dan menjadi gas oksigen (O2).
Reaksi yang terjadi pada elektrolisis air dapat digambarkan sebagai berikut:
2H+ (aq) + 2e- → H2 (g)
O2- (aq) → O2 (g) + 2e-
3. Elektrolisis larutan natrium klorida (NaCl)
Pada elektrolisis larutan natrium klorida, ion natrium (Na+) akan mengalami reaksi reduksi di katoda dan menjadi natrium (Na). Ion klorida (Cl-) akan mengalami reaksi oksidasi di anoda dan menjadi gas klorin (Cl2).
Reaksi yang terjadi pada elektrolisis larutan NaCl dapat digambarkan sebagai berikut:
Na+ (aq) + e- → Na (s)
Cl- (aq) → Cl2 (g) + e-
Kegunaan Elektrolisis
Sel elektrolisis memiliki banyak kegunaan dan sudah banyak di aplikasikan dalam industri maupun dalam kehidupan sehari-hari. Salah satu contoh penggunaan sel elektrolisis adalah pada proses elektropalting atau penyepuhan.
BACA: Penggunaan Sel Elektrolisis Dalam Industri dan Kehidupan Sehari-hari
Berikut contoh-contoh aplikasi yang memanfaatkan sel elektrolisis:
1. Pembuatan logam
Elektrolisis dapat digunakan untuk membuat logam dari bijihnya. Contohnya, elektrolisis larutan tembaga sulfat (CuSO4) dapat menghasilkan tembaga.
2. Pembuatan gas
Elektrolisis dapat digunakan untuk membuat gas, seperti gas oksigen, gas hidrogen, dan gas klorin. Contohnya, elektrolisis air (H2O) dapat menghasilkan gas oksigen dan gas hidrogen.
3. Pembuatan bahan kimia
Elektrolisis dapat digunakan untuk membuat bahan kimia, seperti natrium hidroksida (NaOH) dan asam klorida (HCl). Contohnya, elektrolisis larutan natrium klorida (NaCl) dapat menghasilkan natrium hidroksida dan asam klorida.
4. Pembuatan coating
Elektrolisis dapat digunakan untuk membuat coating pada suatu permukaan, seperti pelapisan logam dengan logam lain. Contohnya, elektroplating adalah proses pelapisan logam emas pada permukaan logam lain.
5. Pembuatan sel baterai
Elektrolisis dapat digunakan untuk membuat sel baterai. Contohnya, elektrolisis larutan asam sulfat (H2SO4) dapat menghasilkan sel baterai asam belerang.
BACA: Laporan Praktikum Elektrokimia: Elektrolisis dan Sel Volta
Kesimpulan
Elektrolisis adalah proses penguraian suatu elektrolit oleh arus listrik. Elektrolisis memiliki banyak kegunaan, antara lain pembuatan logam, pembuatan gas, pembuatan bahan kimia, pembuatan coating, dan pembuatan sel baterai.
Posting Komentar untuk "Sel Elektrolisis: Pengertian, Komponen, Reaksi Elektrolisis dan Contoh Aplikasinya"