Penggunaan Sel Elektrolisis Dalam Industri dan Kehidupan Sehari-hari
Glosaria.com - Beberapa penggunaan sel elektrolisis dalam industri antara lain digunakan pada industri bahan kimia, metalurgi dan kerajinan. Pada kehidupan sehari-hari, sel elektrolis banyak dimanfaatkan dalam proses pemurnian logam, penyepuhan dan pelapisan logam seperti pada pelapisan perhiasan dengan perak atau emas.
Pengertian Sel Elektrolisis
Sel elektrolisis adalah sel yang menggunakan energi listrik untuk melakukan reaksi reduksi-oksidasi (redoks) yang tidak spontan.
BACA: Sel Elektrolisis: Pengertian, Komponen, Reaksi Elektrolisis dan Contoh Aplikasinya
Pada sel elektrolisis, kutub positif merupakan anoda tempat terjadinya reaksi oksidasi. Sedangkan kutub negatif merupakan katoda tempat terjadinya reaksi reduksi.
Penggunaan Sel Elektrolisis
Terdapat beberapa penerapan sel elektrolisis dalam dunia industri. Penggunaan sel elektrolisis telah banyak digunakan seperti pada industri bahan kimia, industri metalurgi (pengolahan logam), dan industri kerajinan.
Sel elektrolisis banyak digunakan dalam industri, seperti industri bahan kimia yaitu untuk pembuatan beberapa bahan kimia, industri metalurgi (pengolahan logam), dan industri kerajinan. Sel elektrolisis dalam kehidupan sehari-hari banyak dimanfaatan dalam proses penyepuhan, pemurnian logam, dan pelapisan logam seperti pada pembuatan perhiasan.
BACA: Laporan Praktikum Elektrokimia: Elektrolisis dan Sel Volta
1. Industri Bahan Kimia
Bahan kimia tertentu, seperti gas klorin dan NaOH dibuat menggunakan cara elektrolisis. Cara ini dinilai lebih ekonomis dibandingkan menggunakan proses kimia biasa.
Larutan NaCl pekat yang diperoleh dari pemekatan air laut dielektrolisis untuk menghasilkan gas klorin dan NaOH. Cara ini memungkinkan untuk memperoleh bahan baku dengan mudah dan murah. Proses produksi gas klorin dan NaOH secara elektrolisis menggunakan sel elektrolisis dengan diafragma yang mencegah terjadinya reaksi antara gas klorin dan NaOH yang dihasilkan.
Reaksi yang terjadi:
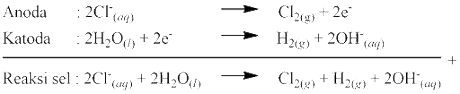
Ion OH- yang dihasilkan bereaksi dengan ion Na+ membentuk NaOH yang selanjutnya dapat dikristalkan. Proses ini menghasilkan gas klorin di anoda, gas H2 di katoda, dan NaOH.
2. Metalurgi
Proses pemisahan (pemurnian) logam dari bijih logam yang menggunakan proses elektrolisis, antara lain:
a. Proses Hall-Heroult
Aluminium didapatkan dari bijih bauksit dengan cara elektrolisis lelehan Al2O3 yang diperoleh dari bijih bauksit. Pada proses ini, lelehan Al2O3 yang dicampur dengan kriolit (Na3AlF6) dielektrolisis dengan menggunakan elektroda dari grafit.
b. Pemurnian Tembaga
Proses pengambilan tembaga dari bijih tembaga pada awalnya dilakukan dengan reduksi. Namun, tembaga yang dihasilkan tidak murni. Tembaga dimurnikan dengan elektrolisis larutan CuSO4. Dalam larutan ini, anoda dibuat dari logam tembaga yang tidak murni dan katoda dibuat dari tembaga murni.
Selama proses elektrolisis ini, tembaga tidak murni yang berada di anoda teroksidasi dan larut sebagai ion Cu2+. Ion Cu2+ bergerak menuju katoda dan mengendap sebagai logam tembaga murni di katoda.
3. Industri Kerajinan
Industri kerajinan banyak menggunakan bahan baku dari logam, seperti perhiasan dan peralatan rumah tangga. Pembuatan kerajinan logam sering menggunakan proses elektrolisis seperti penyepuhan, vernikel, dan verkrom.
Misalnya, kursi lipat besi logam dilapisi logam krom melalui elektrolisis Cr2(SO4)3 dengan anoda logam krom dan katoda dari logam yang akan dilapisi krom. Metode ini dikenal sebagai verkrom.
Pada pembuatan perhiasan berlapis emas, elektrolisis digunakan dalam proses pelapisannya. Perhiasan yang akan dilapisi ditempatkan pada katoda. Sedangkan logam emas yang digunakan untuk menyepuh ditempatkan pada anoda. Dalam proses ini, elektrolit yang digunakan adalah larutan yang mengandung Au3+.
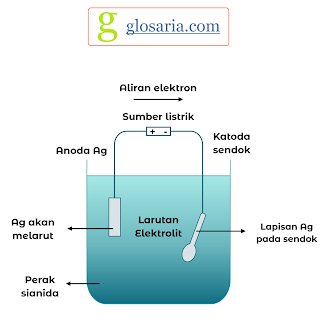 |
| Proses Penyepuhan Logam |
Larutan Au3+ harus dibuat dengan konsentrasi yang rendah agar proses penempelannya sempurna. Jika penempelannya terlalu cepat, proses kristalisasi tidak akan sempurna dan akan menjadi hitam (tidak mengkilap). Apotas (K2CO3.KCN) ditambahkan ke dalam garam Au3+ akan membentuk ion kompleks [Au(CN)6]3-. Penambahan apotas (K2CO3.KCN) bertujuan untuk menjaga konsentrasi Au3+ dalam larutan serendah mungkin.


Posting Komentar untuk "Penggunaan Sel Elektrolisis Dalam Industri dan Kehidupan Sehari-hari"