Laporan Praktikum Sintesis T-butil Klorida Metode Ekstraksi Cair-cair
Laporan praktikum sintesis t-butil klorida dari t-butil alkohol dan HCl dengan metode ekstraksi cair-cair. Praktikum pembuatan t-butil klorida ini bertujuan untuk mempelajari pembentukan alkil halida tersier dan alkohol melalui reaksi substitusi nukleofilik. Pada praktikum ini kita juga akan mempelajari terkait alkohol primer, sekunder, dan tersier serta mekanisme reaksi SN1 dan SN2. Berikut laporan praktikum kimia organik sintesis t-butil klorida selengkapnya.
PRAKTIKUM DASAR-DASAR KIMIA ORGANIK
"SINTESIS T-BUTIL KLORIDA"
A. Tujuan
Mempelajari pembentukan
alkil halida tersier dan alkohol melalui reaksi substitusi nukleofilik.
A. Dasar Teori
1. Reaksi Substitusi Nukleofilik Pada Alkohol
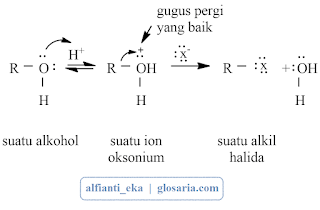
Reaksi substitusi
nukleofilik adalah reaksi penggantian suatu gugus dengan digunkan dua tahap
utamanya, yaitu tahap pertama adalah pelepasan leaving group yang akan
menjadi karbokation dan tahap kedua adalah penyerangan oleh nukleofil terhadap
karbokation tersebut. Terdapat dua macam mekanisme reaksi substitusi, yaitu SNN
dan SN2. Reaksi substitusi nukleofilik adalah reaksi antara suatu
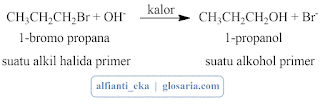
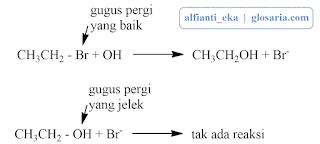
alkil halida dan ion hidroksida. Bila alkil halida primer dipanasi dengan
natrium hidroksida dalam air, terjadi reaksi dengan mekanisme SN2.
Alkil halida sekunder dan tersier menghasilkan produk-produk eliminasi.2. Alkohol Primer, Sekunder, dan Tersier
Alkohol memiliki rumus umum R-OH, dengan R merupakan suatu alkil baik alifatis maupun siklik. Alkohol mempunyai titik didih yang tinggi dibandingkan dengan alkana yang jumlah atom C nya sama karena molekul alkohol membentuk ikatan hidrogen. Semakin banyak cabang pada alkohol maka titik didihnya akan semakin rendah. Kelarutan dalam air, metanol, etanol, propanol mudah larut dan hanya butanol yang sedikit larut (Brady, 1999).
Berdasarkan letak terikatnya gugus hidroksil (-OH), alkohol dapat dibedakan menjadi tiga yaitu sebagai berikut:
a. Alkohol Primer
Alkohol primer merupakan alkohol dengan gugus -OH nya terikat pada atom C primer (atom C yang mengikat 1 atom C lainnya). Contoh alkohol primer:
b. Alkohol Sekunder
Alkohol sekunder merupakan alkohol dengan gugus -OH nya terikat pada atom C sekunder (atom C yang mengikat 2 atom C yang lain). Contoh alkohol sekunder:
c. Alkohol Tersier
Alkohol tersier merupakan alkohol dengan gugus -OH nya terikat pada atom C tersier (atom C yang mengikat 3 atom C yang lain). Contoh alkohol tersier:
(Brady, 1999)
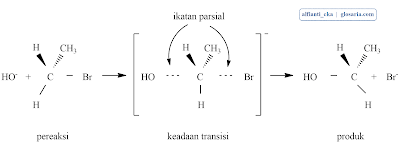
3. Mekanisme Reaksi SN1 dan SN2
a. Mekanisme SN1
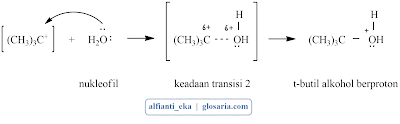
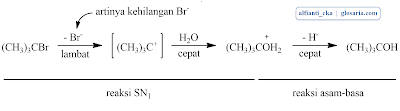
Reaksi SN1 yang terjadi pada suatu alkil halida tersier merupakan reaksi bertahap. Tahap pertama berupa pemutusan alkil halida menjadi sepasang ion, yaitu ion halida dan suatu karbokation. Karena reaksi SN1 melibatkan ionisasi, reaksi-reaksi ini dibantu oleh pelarut seperti H2O, yang dapat menstabilkan ion dengan cara solvasi (solvation).Tahap 2 merupakan terjadinya penggabungan karbokation dengan nukleofil (H2O). Tahap ini menghasilkan produk awal yaitu suatu alkohol berproton.
Tahap terakhir dalam deret ini adalah lepasnya H+ dari dalam alkohol berproton dalam suatu reaksi asam-basa yang cepat dan reversibel dengan pelarut.
(Fessenden dan Fessenden, 1986).
3. Mekanisme SN2
Mekanisme reaksi SN2 hanya terjadi pada alkil halida primer dan sekunder. Nukleofil yang menyerang adalah jenis nukleofil kuat seperti -OH, -CN, CH3O-. Jika sebuah nukleofil menabrak sisi belakang suatu atom karbon tetrahedral yang terikat pada sebuah halogen maka akan terjadi dua peristiwa:(Fessenden dan Fessenden, 1986)
4. Ekstraksi Cair-cair
Ekstraksi cair-cair merupakan proses pemisahan solut dari cairan pembawa (diluen) menggunakan solven cair. Campuran diluen dan solven bersifat heterogen (tidak saling campur). Jika campuran dilakukan pemisahan maka terdapat dua fase, yaitu fase diluen (rafinat) dan fase solven (ekstrak). Fase rafinat merupakan fase residu yang berisi diluen dan sisa solut, sedangkan fase ekstrak merupakan fase yang berisi solut dan solven (Mirwan, 2010).
Ekstraksi cair-cair digunakan untuk memisahkan senyawa atas dasar perbedaan kelarutan pada dua jenis pelarut yang berbeda dan tidak saling bercampur. Bila analit berada dalam pelarut anorganik, maka pelarut yang digunakan adalah pelarut organik. Sebaliknya, jika analit dalam pelarut organik, maka digunakan pelarut anorganik (Khamidinal, 2009).5. t-butil klorida
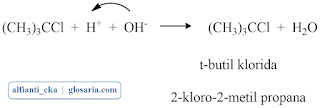
t-butil klorida adalah organochloride dengan rumus (CH3)3CCl. Senyawa ini tidak berwarna dan berupa cairan yang mudah terbakar. Senyawa ini sedikit larut dalam air dengan kecenderungan untuk terhidrolisis dengan alkohol tersier-butil. t-butil klorida diproduksi industri sebagai perkusor untuk senyawa organik lainnya. Ketika tersier-butil klorida dilarutkan dalam air, mengalami hidrolisis untuk t-butil alkohol. Ketika dilarutkan dalam alkohol, eter t-butil sesuai diproduksi (Fernando dkk., 2016).
C. Alat dan Bahan
Alat yang digunakan pada percobaan ini adalah corong pisah 250 mL, statif dan o-ring besar, aluminium foil, kertas saring, corong gelas, gelas ukur 25 mL, gelas ukur 50 mL, gelas beaker 100 mL, gelas ukur 10 mL, sendok sungu, dan botol akuades.
Bahan yang digunakan pada percobaan ini adalah t-butil alkohol (2-metil-2-propanol), larutan HCl pekat, padatan natrium bikarbonat, padatan natrium sulfat anhidrat, dan akuades.
D. Cara Kerja
t-butil alkohol (2-metil-2-propanol) sebanyak 10 gram dan 40 mL HCl 1 M dimasukkan ke dalam corong pisah lalu corong pisah ditutup dan dikocok dengan kencang selama 20 menit. Sesekali keran pada corong pisah dibuka untuk mengurangi tekanan di dalam corong pisah. Setelah dikocok selama 20 menit, corong pisah diletakkan pada ringstand dan dibuka tutup corong pisah lalu dibiarkan selama beberapa menit sampai terlihat dua lapisan. Fasa air (fasa bawah) dipisahkan dari fasa organik (fasa atas). Lapisan organik dicuci dengan 20 mL larutan 5% NaHCO3 lalu dikocok kembali selama 10 menit. Tutup corong pisah dibuka dan dibiarkan selama beberapa menit sampai terlihat dua lapisan. Larutan organik kemudian dipisahkan dan dicuci dengan 20 mL air lalu dikocok kembali selama 10 menit. Setelah dikocok, tutup corong pisah dibuka dan terlihat dua lapisan lalu lapisan bawah dibuang. Kemudian lapisan organik dikeringkan dengan 5% Na2SO4 anhidrous dan disaring menggunakan kertas saring.
E. Data Hasil Pengamatan
|
No. |
Cara Kerja |
Pengamatan |
|
1. |
10 gram 2-metil-2-propanol (t-butil alkohol) dan 40 mL HCl dimasukkan ke dalam corong pisah |
Massa= 10,0333 gram |
|
2. |
Larutan dikocok selama 20 menit. Sesekali keran pada corong pisah dibuka untuk mengurangi tekanan di dalam corong pisah |
Larutan campuran berwarna putih, berbusa, dan terdapat gas |
|
3. |
Tutup corong pisah dibuka dan campuran didiamkan hingga terbentuk dua lapisan |
Terbentuk dua fasa cairan Lapisan atas tidak berwarna Lapisan bawah berwarna keruh |
|
4. |
Larutan air dipisahkan dan lapisan organik dicuci dengan 20 mL larutan NaHCO3 5% |
Lapisan tidak berwarna Lapisan bawah keruh Lapisan atas tidak berwarna |
|
5. |
Lapisan organik dicuci dengan 20 mL air |
Larutan berwarna keruh |
|
6. |
Lapisan organik dikeringkan dengan 5% Na2SO4 |
Terbentuk endapan berwarna putih dan filtratnya tidak berwarna |
|
7. |
Endapan disaring menggunakan kertas saring. Massa dari filtrat ditimbang dan volumenya diukur serta dihitung rendemennya dan massa jenis pada percobaan |
Massa (CH3)3CCl= 5,926 gram Volume (CH3)3CCl= 7,4 mL Rendemen= 47,3145% Massa jenis percobaan= 0,8008 gram/mL |
F. Pembahasan
Percobaan yang
dilakukan berjudul “Sintesis t-butil klorida”. Tujuan dari percobaan ini adalah
mempelajari pembentukan alkil halida tersier dari alkohol melalui reaksi
substitusi nukleofilik. Prinsip kerja yang digunakan pada percobaan ini adalah
reaksi substitusi nukleofilik (SN1) yaitu dengan mereaksikan t-butil
alkohol dengan asam klorida dan prinsip kerja ekstraksi cair-cair yang digunakan
untuk memisahkan senyawa atas dasar perbedaan kelarutan pada dua jenis pelarut
yang berbeda yang tidak saling bercampur.Larutan pertama yang dilakukan adalah t-butil alkohol (2-metil-2-propanol) dan HCl dimasukkan ke dalam corong pisah. Senyawa t-butil alkohol adalah reagen utama yang memiliki struktur C tersier dan gugus -OH. Sementara HCl berfungsi sebagai pemberi gugus -Cl pada t-butil alkohol agar terbentuk t-butil klorida. Kemudian campuran ini diekstraksi selama 20 menit dengan sesekali membuka keran untuk mengeluarkan gas yang dihasilkan. Prinsip dari ekstraksi adalah pemisahan zat berdasarkan perbedaan kepolarannya. Setelah diekstraksi selama 20 menit lalu didiamkan maka akan terbentuk dua fasa pada larutan, yaitu fase air dan fasa organik. Lapisan atas adalah t-butil klorida (2-kloro-2-metil propane) karena memiliki massa jenis yang lebih kecil daripada air, sementara fasa bawah adalah air. Lapisan ini dipisahkan dan dibuang fasa airnya (fasa bawah). Campuran yang diekstraksi mengeluarkan gas dan terdapat tekanan. Tekanan ini muncul karena t-butil alkohol bereaksi secara eksoterm sehingga suhunya meningkat dan menimbulkan tekanan. Berdasarkan percobaan menunjukkan pada saat ekstraksi atau pengocokan menghasilkan buih dan gas, namun lama-kelamaan menjadi hilang. Reaksi yang terjadi antara t-butil alkohol dengan HCl adalah:
Tahap pertama: pembentukan sebuah karbokation dengan pemisahan gugus pergi.
Tahap kedua: penggabungan karbokation dengan nukleofil (HCl)
Tahap ketiga: lepasnya H+ dari t-butil klorida berproton.
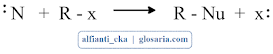
Bentuk umum dari mekanisme reaksi di atas adalah:
Dengan Nu menandakan nukleofil serta R-x menandakan substrat dengan gugus pergi x. pada reaksi tersebut, pasangan elektron dari nukleofil menyerang substrat membentuk ikatan baru, sementara gugus pergi melepaskan diri bersama dengan sepasang elektron.
Tahap selanjutnya dalam percobaan ini adalah pencucian pelarut organik dengan 5% NaHCO3 yang bertujuan untuk mengikat sisa-sisa asam yang terdapat pada klorida. Larutan diekstraksi selama 10 menit lalu didiamkan sampai terbentuk dua lapisan yaitu lapisan halida (atas) dan lapisan NaCl (bawah). Raksi yang terjadi adalah:
Terbentuknya gas CO2 ditandai saat pengocokan terdapat gas pada corong pisah. Setelah itu lapisan bawah dibuang dan lapisan atas dicuci dengan akuades. Larutan dikocok beberapa menit lalu didiamkan sampai terbentuk dua lapisan, lapisan bawahnya dibuang karena mengandung pengotor-pengotor lainnya. Lapisan atas dimasukkan ke dalam gelas beaker. Setelah itu ditambahkan 5% Na2SO4 anhidrous yang bertujuan untuk mengikat air yang masih tersisa dalam halida tersebut. Kemudian larutan tersebut disaring menggunakan kertas saring lalu ditimbang massa, volume, serta rendemen.
Berdasarkan hasil percobaan diperoleh volume t-butil klorida sebanyak 7,4 mL serta massanya adalah 5,926 gram. Rendemen yang didapatkan sebesar 47,3145% dan massa jenis (CH3)3CCl pada percobaan adalah 0,8008 gram/mL.
G. Kesimpulan
Berdasarkan
percobaan yang berjudul “Sintesis t-butil klorida” dapat disimpulkan bahwa
pembentukan alkil halida tersier dari alkohol melalui reaksi substitusi
nukleofilik (SN1) dihasilkan produk berupa t-butil klorida dengan
rendemen sebesar 47,3145% dan pembentukan t-butil klorida diperoleh dengan
melakukan metode pemisahan (ekstraksi cair-cair).
H. Daftar Pustaka
- Brady, J. 1999. Kimia Organik Jilid 1. Jakarta: Bina Aksara.
- Fernando, C., Nafrialdo, R., & Anggelinov, F. 2016. Pembuatan t-Butil Klorida. Laporan Praktikum Sintesis Kimia Organik.
- Fessenden, R. J., & Fessenden, J. S. 1986. Kimia Organik Jilid 2. Jakarta: Erlangga.
- Khamidinal. 2009. Teknik Laboratorium Kimia. Yogyakarta: Pustaka Pelajar.
- Mirwan, A. 2010. Keberlakuan Model HB-GFT Sistem n-Heksana-Mek-Air Pada Ekstraksi Cair-Cair Kolom Isian. INFO-TEKNIK, 11(1): 1-20.
Lampiran
Perhitungan Sintesis Tersier Butil Klorida
Diketahui:
- Massa HCl
= volume x massa jenis
= 40 mL x 1,1800 gram/mL- Mol HCl
= massa : Mr
= 47,2 gram : 36,5 g/mol
- Mol (CH3)3COH
= 10,0333 gram : 74,123 g/mol
= 0,1353 mol
|
|
(CH3)3COH |
+ |
HCl |
-> |
(CH3)3CCl |
+ |
H2O |
|
M |
0,1353 |
|
1,2931 |
|
- |
|
- |
|
R |
0,1353 |
|
0,1353 |
|
0,1353 |
|
0,1353 |
|
S |
- |
|
1,1578 |
|
0,1353 |
|
0,1353 |
a. Massa (CH3)3CCl teori
= mol x M
= 0,1353 mol x 92,57 gram/mol
= 12,5247 gram
= (massa hasil percobaan : volume hasil percobaan) x 100%
= (5,926 gram : 7,4 mL) x 100%
= 0,8008 gram/mL

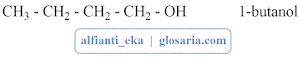
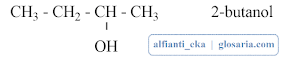

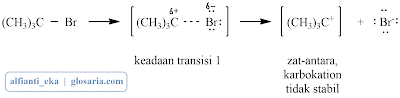



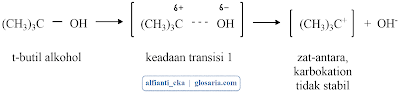



Posting Komentar untuk "Laporan Praktikum Sintesis T-butil Klorida Metode Ekstraksi Cair-cair"