Laporan Praktikum Sintesis Kloroform Metode Destilasi dan Ekstraksi Cair-cair
Laporan praktikum sintesis kloroform dari kaporit dan aseton dengan metode ekstraksi cair-cair. Praktikum pembuatan kloroform bertujuan untuk mempelajari reaktivitas hidrogen alfa pada aseton dalam sintesis kloroform. Metode yang digunakan pada praktikum sintesis kloroform adalah destilasi dan dilanjutkan dengan ekstraksi cair-cair. Berikut laporan praktikum kimia organik sintesis kloroform.
"SINTESIS KLOROFORM"
A. Tujuan
Mempelajari reaktivitas hidrogen alfa pada aseton dalam sintesis kloroform.
B. Dasar Teori
1. Kloroform
Kloroform adalah cairan yang tidak larut dalam air tetapi dapat larut dengan alkohol dan minyak. Kloroform merupakan senyawa haloalkana yang dapat mengikat tiga atom Cl. Rantai karbon pada senyawa kloroform dapat terdiri dari komponen dasar berupa senyawa organik dimana gugus metil (-CH3) yang akan terikat pada atom C karbonil (C=O) atau C hidroksil (C-OH) bereaksi dengan pereaksi halogen Cl2 (Basset, 1994).
Kloroform dibuat dari alkohol dengan kapur klor atau bubuk pemutih (CaOCl2) dengan tiga tahap:
- Oksidasi halogen
- Klorasi dari hasil oksidasi
- Hidrolisis alkalis dari senyawa yang terbentuk
Selain dari alkohol, sintesis kloroform juga dapat dibuat dengan aseton (Senisedil, 1992).
2. Hidrogen Alfa
Ikatan karbon-hidrogen umumnya bersifat stabil, non-polar, dan non-asam. Namun dengan gugus
karbonil, terdapat hidrogen alfa yang bersifat asam. Hidrogen berada pada posisi alfa, dan ketika berada dalam dua gugus karbonil maka hidrogen cukup asam sehingga membentuk
garam dengan mengolah senyawa tersebut. Sifat asam yang dimiliki hidrogen alfa disebabkan oleh
karbon alfa yang mengambil sebagian muatan positif (efek induktif oleh penarikan
elektron) sehingga ikatan C-H menjadi lemah serta karena adanya stabilitas
resonansi dari ion enolat yang terbentuk bila proton terlepas (Fessenden dan Fessenden,
1986).
3. Destilasi
Destilasi merupakan teknik pemisahan yang didasari atas perbedaan titik didih dari masing-masing zat penyusun dari campuran homogen. Dalam proses destilasi terdapat dua tahap yaitu tahap penguapan dan dilanjutkan dengan tahap pengembunan kembali uap menjadi cair atau padatan. Atas dasar ini maka perangkat destilasi menggunakan alat pemanas dan pendingin. Proses destilasi diawali dengan pemanasan, sehingga zat yang memiliki titik didih yang lebih rendah akan menguap. Uap tersebut bergerak menuju kondensor yaitu pendingin. Proses pendinginan terjadi karena air mengalir ke dalam dinding (bagian luar kondensor) sehingga uap yang dihasilkan akan kembali cair. Proses ini berjalan terus-menerus dan akhirnya senyawa-senyawa yang terdapat dalam campuran homogen dapat dipisahkan (Sugihara, 1961).
 |
| Sintesis Kloroform Metode Destilasi |
4. Ekstraksi Cair-cair
Ekstraksi cair-cair merupakan proses pemisahan solut dari cairan pembawa (diluen) menggunakan solven cair. Campuran diluen dan solven bersifat heterogen (tidak saling campur). Jika campuran dilakukan pemisahan maka terdapat dua fase, yaitu fase diluen (rafinat) dan fase solven (ekstrak). Fase rafinat merupakan fase residu yang berisi diluen dan sisa solut, sedangkan fase ekstrak merupakan fase yang berisi solut dan solven (Mirwan, 2010).
Ekstraksi cair-cair digunakan untuk memisahkan senyawa atas
dasar perbedaan kelarutan pada dua jenis pelarut yang berbeda dan tidak saling
bercampur. Bila analit berada dalam pelarut anorganik, maka pelarut yang
digunakan adalah pelarut organik. Sebaliknya, jika analit dalam pelarut
organik, maka digunakan pelarut anorganik (Khamidinal, 2009).
5. Aseton
Aseton (dimetil keton atau 2-propanon) adalah senyawa penting dari alifatik keton. Pembuatan aseton pertama kali dihasilkan dengan cara destilasi kering dari kalsium asetat. Kemudian proses tersebut digantikan dengan fermentasi karbohidrat menjadi aseton, butil, dan etil-alkohol. Prosesnya kembali mengalami perbaharuan, yaitu proses dehidrogenasi 2-propanol dan oksidasi menjadi fenol dan aseton. Penggunaan metode tersebut pada produksi aseton di seluruh dunia telah menghasilkan lebih dari 95% aseton (Intani, 2009).
C. Alat dan Bahan
Alat yang digunakan pada percobaan ini adalah alat destilasi, tutup karet, tutup karet berlubang, statif + klem, mantel pemanas, klem o-ring, corong pisah 100 mL, Erlenmeyer 50 mL dan 100 mL, gelas ukur 5 mL, gelas beaker 50 mL, pipet ukur 5 mL dan 10 mL, bola hisap, sendok sungu, corong gelas 75 mm, gelas arloji besar, pengaduk, termometer, lumpang porselen, alumunium foil, kertas saring, dan botol akuades.
Bahan yang digunakan pada percobaan ini adalah 25 gram, kaporit, aseton, NaOH 2%, CaCl2 anhidrat, dan akuades.
D. Cara Kerja
Sebanyak 25 gram kaporit dihaluskan menggunakan lumpang porselen dengan penambahan akuades sedikit demi sedikit. Setelah halus dimasukkan ke dalam labu leher tiga. Sementara itu, 25 mL akuades dimasukkan ke dalam penampang destilasi. Selanjutnya 6,5 gram aseton dimasukkan dalam corong pisah. Set destilasi yang telah dipasang digunakan untuk mensintesis kloroform. Corong pisah yang berisi aseton diteteskan sedikit demi sedikit ke dalam labu destilasi yang berisi kaporit dan dilanjutkan dengan pemanasan pada suhu 60 oC. Setelah kloroform tidak menetes, kloroform dipisahkan dari air dengan cara diekstraksi. Setelah itu, kloroform diambil dan ditabahkan NaOH sebanyak 2 tetes dan dikeringkan dengan CaCl2 anhidrat.
E. Data Hasil Pengamatan
|
No. |
Cara Kerja |
Pengamatan |
|
1. |
Kaporit dihaluskan + akuades |
Massa kaporit = 25,0040 gram |
|
2. |
Dituang dalam labu destilasi |
Berbentuk seperti pasta |
|
3. |
2,5 mL akuades dituang ke dalam penampung destilat |
Agar destilat tidak menguap |
|
4. |
6,5 gram aseton dituang dalam corong pisah (tetes demi tetes) |
Massa aseton = 6,5116 gram |
|
5. |
Dipanaskan suhu 60 oC |
Hingga terbentuk kloroform |
|
6. |
Kloroform dipisahkan dari air |
Digunakan corong pisah |
|
7. |
Kloroform dicuci dengan NaOH 2% |
NaOH 2% sebanyak 2 tetes |
|
8. |
Kloroform dikeringkan dengan CaCl2 anhidrat |
Satu sendok sungu kecil |
|
9. |
Hasil |
Massa = 2,7885 gram Volume = 2,7 mL Massa jenis = 1,0327 g/mL Rendemen = 20,8184% |
F. Pembahasan
Percobaan yang dilakukan berjudul Sintesis Kloroform. Tujuan dari percobaan ini yaitu untuk mempelajari reaktivitas hidrogen alfa pada aseton dalam sintesis kloroform. Prinsip kerja yang digunakan pada percobaan ini adalah pemisahan dengan metode destilasi dan ekstraksi. Destilasi merupakan proses pemisahan berdasarkan perbedaan titik didih yang dilakukan pada saat pemisahan berdasarkan aseton dengan kloroform dengan cara dipanaskan. Ekstraksi merupakan proses pemisahan berdasarkan kemampuan suatu zat untuk melarut pada dua pelarut yang tidak saling bercampur yang dilakukan pada saat memisahkan kloroform dengan akuades dan kloroform dicuci dengan NaOH 2% serta CaCl2 anhidrat.
Percobaan diawali dengan penimbangan kaporit kemudian dihaluskan dengan menggunakan lumpang porselen. Kaporit terlebih dahulu ditambahkan akuades sedikit demi sedikit pada saat dihaluskan sampai membentuk seperti pasta. Penghalusan kaporit bertujuan untuk memperbesar luas permukaan kaporit dan memperkecil ukuran partikelnya. Sehingga dengan lebih luasnya permukaan akan mempercepat reaksi dan mempermudah kaporit untuk bereaksi dengan air maupun aseton. Penambahan akuades bertujuan untuk melarutkan kaporit dan mengurangi penguapan destilat. Kemudian kaporit dimasukkan ke dalam labu leher tiga. Proses pencampuran kaporit dan air menghasilkan senyawa Ca(OH)2 yang bersifat basa dan gas Cl2 berdasarkan reaksi berikut:
![]()
Setelah itu, aseton dimasukkan ke dalam corong pisah. Pada ujung konduktor lainnya dipasang penampung destilat yang telah diberi akuades. Ujung pipa penetes destilat diusahakan untuk tercelup pada akuades agar akuades dapat menangkap hasil reaksi yaitu kloroform. Fungsi utama akuades adalah untuk menjaga agar destilat tidak menguap mengingat sifat kloroform sangat mudah menguap. Penampung destilat juga dipasang alumunium foil untuk menghindari kontaminasi dari zat lain dan penguapan kloroform.
Corong pisah yang berisi aseton diteteskan sedikit demi sedikit ke dalam kaporit. Kemudian akan muncul buih dalam kaporit yang menandakan terdapat gas Cl2 dalam campuran. Gas Cl2 yang berasal dari kaporit dan air bereaksi dengan aseton akan membentuk kloroform. mekanisme reaksi sintesis kloroform yang terjadi sebagai berikut:
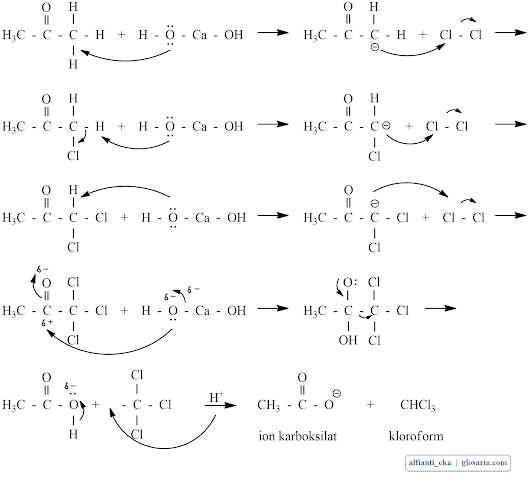 |
| Mekanisme reaksi sintesis kloroform |
Selanjutnya dilakukan proses destilasi pada suhu 60 oC. hal ini dikarenakan titik didih kloroform sekitar 61-63 oC. suhu destilasi seharusnya tidak melebihi suhu tersebut. Hal ini dilakukan agar senyawa produk tidak mengalami kerusakan dan produk hanya berupa kloroform bukan senyawa lain. Kloroform yang dihasilkan akan menetes ke dalam penampung destilat. Pada saat inilah terjadi reaksi halogenasi. Reaksi terjadi substitusi halogen pada C-alfa dimana pada reaksi tersebut halogen yang bereaksi yaitu Cl. Ion Cl- merupakan nukleofil yang masuk pada C kedua yang memiliki muatan negatif. Cl melakukan substitusi berulang-ulang kepada C kedua karena terjadi reaksi multi halogenasi yaitu terjadi substitusi halogen pada atom C-alfa yang berulang-ulang. Setelah destilat tidak menetes lagi, proses destilasi dihentikan dan didapatkan produk berupa kloroform.
Perlakuan selanjutnya yaitu kloroform yang dihasilkan diekstraksi menggunakan corong pisah untuk memisahkan antara kloroform dan air. Prinsip kerja ekstraksi cair-cair yaitu didasarkan pada distribusi zat terlarut dengan perbandingan tertentu antara dua pelarut yang tidak saling bercampur. Setelah dilakukan ekstraksi maka terbentuk dua lapisan yaitu lapisan kloroform (organik) dan lapisan air. Kloroform memiliki massa jenis yang lebih besar daripada air maka kloroform berada pada bagian bawah. Setelah itu lapisan bawah diambil dan ditambahkan NaOH 2% yang berfungsi untuk mengikat pengotor-pengotor pada produk sehingga kloroform yang dihasilkan lebih murni. Kemudian kloroform dikeringkan dengan CaCl2 anhidrat agar air yang masih terdapat dalam kloroform dapat terikat dan hilang. Reaksi yang terjadi sebagai berikut:
![]()
Berdasarkan percobaan ini diperoleh rendemen sebanyak 20,8184% dan massa jenis sebesar 1,0327 g/mL. Massa jenis kloroform yang dihasilkan lebih kecil dari massa jenis teori yaitu 1,49 g/mL. hal tersebut dikarenakan pada saat destilasi reaksi tidak berjalan sempurna dimana kloroform terkontaminasi gas Cl2.
G. Kesimpulan
Berdasarkan percobaan yang dilakukan dapat disimpulkan bahwa telah dipelajari reaktivitas hidrogen alfa yang merupakan reaksi halogenasi pada aseton dalam sintesis kloroform. Rendemen yang dihasilkan sebanyak 20,8184% dan massa jenis sebesar 1,0327 g/mol.
H. Daftar Pustaka
- Basset. (1994). Buku Ajar Vogel Kimia Analisis Kuantitatif Anorganik. Jakarta: Penerbit Buku Kedokteran EGC.
- Fessenden, R. J., & Fessenden, J. S. (1986). Kimia Organik Jilid 2. Jakarta: Erlangga.
- Intani, A. S. (2009). Prarancangan Pabrik Aseton Proses Dehidrogenasi Isopropil Alkohol Kapasitas 19.500 Ton/Tahun. Tesis. Universitas Muhammadiyah Surakarta.
- Khamidinal. (2009). Teknik Laboratorium Kimia. Yogyakarta: Pustaka Pelajar.
- Mirwan, A. (2010). Keberlakuan Model HB-GFT Sistem n-Heksana-Mek-Air Pada Ekstraksi Cair-Cair Kolom Isian. INFO-TEKNIK, 11(1): 1-20.
- Senisedil. (1992). Kimia dan Petunjuk Praktikum Kimia Preparatif. Yogyakarta: UGM Press.
- Sugihara. (1961). Distilasi Sederhana. Bandung: ITB Press.
Lampiran
Perhitungan Sintesis Kloroform
Massa kaporit = 25,0040 gram
Mr kaporit = 142,98 g/mol
Massa aseton = 6,5116 gram
Massa jenis aseton = 0,78 g/mL
Mr aseton = 58 g/mol
Mr kloroform = 119,38 g/mol
= 25,0040 gram : 142,98 g/mol
= 0,1748 mol
- Mol aseton
= massa : Mr
= 6,5116 gram : 58 g/mol
= 0,1122 mol
|
|
Ca(OCl)2 |
+ |
C3H6O |
-> |
CHCl3 |
+ |
(CH3COO)2Ca |
|
M |
0,1748 |
|
0,1122 |
|
- |
|
- |
|
R |
0,1122 |
|
0,1122 |
|
0,1122 |
|
0,1122 |
|
S |
0,0626 |
|
- |
|
0,1122 |
|
0,1122 |
- Massa kloroform (teori)
= mol x Mr
= 0,1122 mol x 119,38 g/mol
= 13,3944 gram
- Rendemen
= (massa percobaan : massa teori) x 100%
= (2,7885 gram : 13,3944 gram) x 100%
= 20,8184%
- Massa jenis percobaan
= massa : volume
= 2,7885 gram : 2,7 mL
= 1,0327 g/mL

Posting Komentar untuk "Laporan Praktikum Sintesis Kloroform Metode Destilasi dan Ekstraksi Cair-cair"