Laporan Praktikum Stoikiometri Reaksi Asam-Basa dan Pengendapan
Praktikum stoikiometri ini bertujuan untuk menentukan koefisien reaksi berdasarkan pembentukan endapan dan perubahan temperatur serta menentukan hasil reaksi berdasarkan konsep mol. Beberapa hal yang dipelajari pada praktikum ini antara lain: konsep mol, stoikiometri asam-basa, stoikiometri pengendapan, persamaan reaksi, reaksi pembatas, koefisien reaksi, dan rendemen.
“STOIKIOMETRI REAKSI KIMIA”
A. Tujuan
2. Menentukan hasil reaksi berdasarkan konsep mol.
B. Dasar Teori
1. Stoikiometri
Stoikiometri adalah ilmu yang mempelajari kuantitas dari reaktan dan produk dalam reaksi kimia. Reaksi kimia yaitu suatu proses dimana zat atau senyawa diubah menjadi satu atau lebih senyawa baru. Untuk berkomunikasi satu sama lain tentang reaksi kimia, para kimiawan menggunakan cara standar untuk menggambarkan reaksi tersebut melalui persamaan kimia. Persamaan kimia menggunakan lambang kimia untuk menunjukkan apa yang terjadi saat reaksi kimia berlangsung (Chang, 2004).
2. Persamaan Reaksi Kimia
Persamaan reaksi apabila jumlah bilangan sebelah kiri dan kanan harus sama. Suatu reaksi belum dikatakan persamaan sebelum diberikan koefisien reaksi untuk mendapatkan keadaan setimbang dan diberikan istilah persamaan kimia, menyatakan bahwa persamaan itu telah disetimbangkan. Untuk menyatakan suatu reaksi belum diberikan koefisien reaksi sering disebut persamaan belum disetimbangkan (Petrucci, 1987).
Reaksi antara gas nitrogen dan gas hidrogen yang menghasilkan gas amonia. Reaksi tersebut merupakan reaksi gas homogen karena berasal dari wujud yang sama yaitu gas (Charles, 1980).
N2(g) + 3H2(g) -> 2NH3(g)
Koefisien reaksi dari senyawa N2 yaitu jumlah mol dari N2=1, koefisien dari senyawa H2 yaitu jumlah mol dari H2=3. Koefisien reaksi dari NH3 yaitu jumlah mol dari NH3=2. Koefisien reaksi dapat menentukan pereaksi pembatas, hasil yang didapatkan dari suatu reaksi dan banyak bahan baku yang harus disediakan untuk memperoleh hasil (Keenan, 1980).
Dua metode yang digunakan perkiraan komposisi yang menghasilkan jumlah endapan maksimum adalah 20 mL NaOH 0,1M dan 10 mL CuSO4 0,1M. Selain itu, perkiraan komposisi yang akan menghasilkan temperatur tertinggi adalah 15 mL NaOH 1,0M dan 10 mL CuSO4 0,1M.
Koefisien reaksi dapat ditentukan dengan cara melakukan perbandingan tiap mol campuran. dalam suatu reaksi, reaktan biasanya tidak terdapat dalam jumlah stoikiometri yang tepat yaitu dalam perbandingan yang ditunjukkan oleh persamaan yang setara. Tujuan reaksi adalah menghasilkan kuantitas maksimum senyawa yang berguna dari sejumlah tertentu material awal, seringkali suatu reaktan dimasukkan dalam jumlah berlebih untuk menjamin bahwa reaktan yang lebih mahal seluruhnya diubah menjadi produk yang diinginkan. Konsekuensinya beberapa reaktan akan tersisa pada akhir reaksi (Chang, 2004).
3. Reaksi Pembatas
Reaktan yang pertama kali habis digunakan pada reaksi kimia disebut pereaksi pembatas, karena jumlah maksimum produk yang terbentuk tergantung pada beberapa banyak jumlah awal dari reaktan ini. Jika reaktan ini telah digunakan semua, tidak ada lagi produk yang terbentuk. Pereaksi yang terdapat dalam jumlah lebih besar daripada yang diperlukan untuk bereaksi dengan sejumlah tertentu pereaksi pembatas disebut pereaksi berlebih (Chang, 2004).
Reaksi 10 mL NaOH 0,1M dan 20 mL CuSO4 0,1M yang merupakan pereaksi pembatas adalah NaOH. Reaksi 15 mL NaOH 0,1M dan 15 mL CuSO4 0,1M pereaksi pembatas adalah NaOH. Reaksi antara 20 mL NaOH 0,1M dan 10 mL CuSO4 0,1M tidak ada reaksi pembatas. Reaksi antara 25 mL NaOH 0,1M dan 5 mL CuSO4 0,1M pereaksi pembatasnya adalah CuSO4.
Jumlah pereaksi pembatas yang ada pada awal reaksi menentukan hasil teoritis dari reaksi tersebut, yaitu jumlah produk yang akan terbentuk jika seluruh pereaksi pembatas terpakai pada reaksi. Hasil teoritis adalah hasil maksimum yang didapat, seperti yang diprediksi dalam persamaan yang setara. Hasil sebenarnya sebagai jumlah produk sebenarnya yang dihasilkan dari suatu reaksi. Menentukan efisiensi dari suatu reaksi menggunakan persen hasil yang dapat dijabarkan sebagai perbandingan hasil sebenarnya terhadap hasil teoritis. Rendemen teoritis yaitu banyaknya suatu hasil reaksi yang diperhitungkan dan diperoleh jika reaksi itu sempurna. Rendemen persamaan yaitu rendemen nyata suatu rumus reaksi dibagi dengan rendemen teoritis dikali 100%. Persen hasil dapat berada antara 1-100 %. Faktor yang dapat mempengaruhi persen hasil dari suatu reaksi adalah suhu dan tekanan (Chang, 2004).
Persamaan reaksi yang terjadi pada percobaan stoikiometri asam basa sebagai berikut:
HCl(aq) + NaOH(aq) -> NaCl(aq) + H2O(l)
Persamaan reaksi yang terjadi pada percobaan stoikiometri reaksi pengendapan sebagai berikut:
2NaOH(aq) + CuSO4(aq) -> Na2SO4(aq) + Cu(OH)2(s)
C. Alat dan Bahan
Alat yang digunakan dalam percobaan ini adalah gelas arloji, gelas beaker 50 mL, gelas beaker 250 mL, erlenmeyer 50 mL, gelas ukur 25 mL, pengaduk kaca, corong gelas, pipet tetes, toples, mistar, termometer, penangas air, kertas saring, label, neraca analitik, dan botol akuades. Bahan yang digunakan dalam percobaan ini adalah larutan NaOH 0,1M, larutan NaOH 1,0M, Larutan HCl 1,0M, larutan CuSO4 0,1M, dan akuades.
D. Cara Kerja
Pada praktikum ini yang dilakukan terlebih dahulu adalah stoikiometri reaksi asam basa dengan cara NaOH 1,0M dan HCl 1,0M masing-masing dimasukkan ke dalam gelas beaker dan diukur suhunya dalam penangas air. Kedua larutan dicampur dengan variasi volume:
- 5 mL NaOH 1,0M dan 25 mL HCl 1,0M
- 10 mL NaOH 1,0M dan 20 mL HCl 1,0M
- 15 mL NaOH 1,0M dan 15 mL HCl 1,0M
- 20 mL NaOH 1,0M dan 10 mL HCl 1,0M
- 25 mL NaOH 1,0M dan 5 mL HCl 1,0M
Percobaan yang kedua yaitu stoikiometri reaksi pengendapan dengan cara NaOH 0,1M dan CuSO4 0,1M masing-masing dimasukkan ke dalam gelas beaker. Kedua larutan dicampur sesuai variasi volume dan dilakukan pengadukan 30 detik lalu didiamkan selama 5 menit hingga terbentuk endapan. Endapan yang terbentuk kemudian disaring menggunakan kertas saring. Residu yang dihasilkan dikeringkan dalam oven. Residu kering ditimbang menggunakan neraca analitik. Variasi volume yang digunakan:
- 5 mL NaOH 0,1M dan 25 mL CuSO4 0,1M
- 10 mL NaOH 0,1M dan 20 mL CuSO4 0,1M
- 15 mL NaOH 0,1M dan 15 mL CuSO4 0,1M
- 20 mL NaOH 0,1M dan 10 mL CuSO4 0,1M
- 25 mL NaOH 0,1M dan 5 mL CuSO4 0,1M
E. Data Hasil Pengamatan
1. Stoikiometri Reaksi Asam Basa
|
Volume Larutan (mL) |
T awal (oC) |
T Rata-rata (oC) |
T akhir (oC) |
T selisih (oC) |
||
|
NaOH 1M |
HCl 1M |
NaOH 1M |
HCl 1M |
|||
|
5 |
25 |
29 |
28 |
28,5 |
30 |
1,5 |
|
10 |
20 |
29 |
28 |
28,5 |
32 |
3,5 |
|
15 |
15 |
29 |
28 |
28,5 |
32,5 |
4 |
|
20 |
10 |
28,5 |
28 |
28,5 |
31 |
2,75 |
|
25 |
5 |
28 |
28 |
28 |
30 |
1,5 |
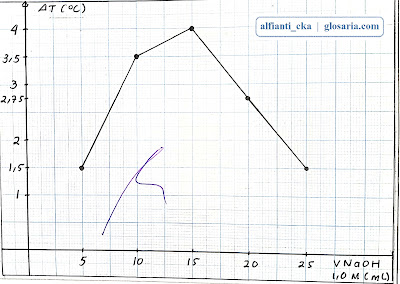 | ||
| Grafik hubungan perubahan suhu terhadap volume NaOH 1,0M |
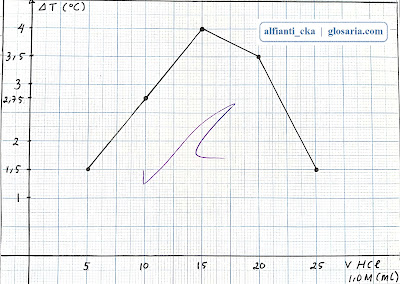 |
| Grafik hubungan perubahan suhu terhadap volume HCl 1,0M |
2. Stoikiometri Reaksi Pengendapan
|
Volume Larutan (mL) |
Tinggi Endapan |
Warna |
Massa (g) |
||
|
NaOH 0,1M |
HCl 0,1M |
Larutan |
Endapan |
||
|
5 |
25 |
1 |
Biru muda |
Biru muda |
0,0442 |
|
10 |
20 |
3 |
Biru muda |
Biru |
0,0823 |
|
15 |
15 |
5 |
Biru muda |
Biru |
0,0449 |
|
20 |
10 |
13 |
Tak berwarna |
Hitam kehijauan |
0,0833 |
|
25 |
5 |
8 |
Tak berwarna |
Hijau tua |
0,0393 |
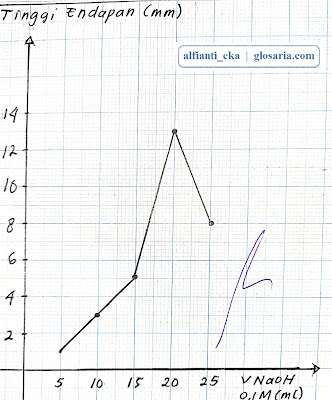 |
| Grafik hubungan tinggi endapan terhadap volume NaOH 0,1M |
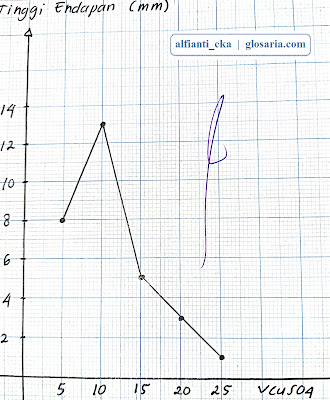 |
| Grafik hubungan tinggi endapan terhadap volume CuSO4 0,1M |
F. Pembahasan
Percobaan yang dilakukan berjudul Stoikiometri Reaksi dengan tujuan untuk menentukan koefisien reaksi berdasarkan pembentukan endapan dan perubahan temperatur serta untuk menentukan hasil reaksi berdasarkan konsep mol. Prinsip kerja dari percobaan ini adalah stoikiometri yaitu ilmu tentang pengukuran perbandingan kuantitatif atau pengukuran perbandingan jumlah dan metode variasi kontinu yaitu sederet pengamatan dengan jumlah volume tiap pereaksinya diubah-ubah tetapi jumlah volume totalnya tetap. Perubahan volume sesuai metode variasi kontinu dapat digunakan untuk menentukan titik optimum dan untuk mendapatkan perbandingan jumlah mol.
Percobaan pertama yang dilakukan yaitu stoikiometri reaksi asam basa dengan lima perlakuan yang berbeda. Perlakuan pertama dengan pengukuran termometer didapatkan suhu awal NaOH 29oC, suhu awal HCl 28oC, suhu campuran 30oC dan selisih suhunya 1,5oC. NaOH merupakan pereaksi pembatas dan HCl merupakan pereaksi sisa. Perlakuan kedua dengan pengukuran termometer didapatkan suhu awal NaOH 29oC, suhu awal HCl 28oC, suhu campuran 32oC dan selisih suhunya 3,5oC. NaOH merupakan pereaksi pembatas dan HCl merupakan pereaksi sisa. Perlakuan ketiga dengan pengukuran termometer didapatkan suhu awal NaOH 29oC, suhu awal HCl 28oC, suhu campuran 32,5oC, dan selisih suhunya 4oC. reaksi ini merupakan reaksi stoikiometri karena kedua reaktan habis bereaksi. Perlakuan keempat dengan pengukuran termometer didapatkan suhu awal NaOH 28,5oC, suhu awal HCl 28oC, suhu campuran 31oC dan selisih suhunya 2,75oC. HCl merupakan pereaksi pembatas dan NaOH merupakan pereaksi sisa. Perlakuan kelima dengan pengukuran termometer didapatkan suhu awal NaOH 28oC, suhu awal HCl 28oC, suhu campuran 30oC dan selisih suhunya 1,5oC. HCl merupakan pereaksi pembatas dan NaOH merupakan pereaksi sisa.
Pada percobaan stoikiometri reaksi asam basa perlu menghitung suhu awal dan suhu campuran untuk memperoleh selisih suhu. Koefisien reaksi dapat diperoleh berdasarkan titik optimum dari grafik yang menyatakan hubungan antara perubahan temperatur dengan volume asam basa. Suhu tertinggi yang terdapat pada suatu campuran disebut titik optimum. Suhu terendah pada suatu campuran disebut titik minimum. Dari hasil pengamatan, bila NaOH bereaksi dengan HCl, maka akan menghasilkan NaCl dan H2O dengan persamaan reaksi sebagai berikut:
NaOH(aq) + HCl(aq) -> NaCl(aq) + H2O(l)
Koefisien dari reaksi setara tersebut menunjukkan jumlah mol yang merupakan titik stoikiometri pada reaksi tersebut. Karena volume reaktan pada lima perlakuan dibuat berbeda dan kontinu, maka perubahan volume tersebut dapat digunakan untuk menentukan titik optimum dan mendapatkan perbandingan jumlah mol.
Diketahui dari grafik hubungan antara perubahan temperatur dengan volume asam basa diperoleh titik optimumnya pada 15 mL NaOH 1,0M dan 15 mL HCl 1,0M pada selisih suhu 4oC. Berdasarkan hasil percobaan, diperoleh perbandingan molnya 1:1, ini sesuai dengan perbandingan koefisien reaksi. Titik optimum tidak terdapat pada titik minimum, karena pada grafik titik minimum terjadi pada saat perlakuan pertama dan kelima dimana kedua perlakuan itu perbandingan molnya berturut-turut 1:5 dan 5:1. Ini tidak sesuai dengan koefisien reaksi 1:1.
Percobaan kedua yaitu stoikiometri reaksi pengendapan dilakukan dengan lima perlakuan yang berbeda. Perlakuan pertama diperoleh tinggi endapan sebesar 1 mm dan massa endapan 0,0442 gram. Pada larutan menghasilkan warna biru muda dan pada endapan menghasilkan warna biru muda. Perlakuan kedua diperoleh tinggi endapan 3 mm dan massa endapan 0,0823 gram. Pada larutan menghasilkan warna biru muda dan pada endapan menghasilkan warna biru. Perlakuan ketiga diperoleh tinggi endapan 5 mm dan massa endapan 0,0449 gram. Pada larutan menghasilkan warna biru muda dan pada endapan menghasilkan warna biru. Perlakuan keempat diperoleh tinggi endapan 13 mm dan massa endapan 0,0833 gram. Pada larutan tidak menghasilkan warna dan pada endapan menghasilkan warna hijau kehitaman. Perlakuan kelima diperoleh tinggi endapan 8 mm dan massa endapan 0,393 gram. Pada larutan tidak menghasilkan warna dan pada endapan menghasilkan warna hijau tua.
Percobaan kedua yang terjadi antara NaOH dan CuSO4 merupakan reaksi pengendapan yang dicirikan dengan terbentuknya produk yang tidak larut atau endapan. Endapan yang dihasilkan yaitu Cu(OH)2 berwarna gelap dengan tekstur lunak. Warna endapan berbeda-beda tergantung pada volume NaOH yang dilarutkan. Semakin banyak volume NaOH yang dicampurkan akan menghasilkan warna endapan yang semakin gelap. Sebaliknya jika volume NaOH yang dicampurkan semakin sedikit, maka warna endapan yang dihasilkan semakin cerah. Penambahan volume NaOH juga berpengaruh pada ketinggian endapan Cu(OH)2. Semakin banyak volume NaOH yang dicampurkan maka endapan yang dihasilkan semakin tinggi. Sebaliknya jika volume NaOH yang dicampurkan semakin sedikit, maka endapan yang dihasilkan semakin rendah. Berdasarkan pengamatan, bila NaOH direaksikan dengan CuSO4, maka akan menghasilkan Na2SO4 dan Cu(OH)2 dengan persamaan reaksi sebagai berikut:
2NaOH(aq) + CuSO4(aq) -> Cu(OH)2(s) + Na2SO4(aq)
Koefisien dari reaksi setara tersebut menunjukkan jumlah mol yang merupakan titik stoikiometri pada reaksi tersebut. Karena volume reaktan pada lima perlakuan dibuat berbeda dan kontinu, maka perubahan volume tersebut dapat digunakan untuk menentukan titik optimum dan mendapatkan perbandingan jumlah mol. Berdasarkan grafik hubungan antara tinggi endapan terhadap volume diperoleh titik optimumnya pada 20 mL NaOH 0,1M dan 10 mL CuSO4 0,1M pada ketinggian endapan maksimum yaitu 13 mm. berdasarkan hasil percobaan, diperoleh perbandingan molnya 2:1 sesuai dengan perbandingan koefisien reaksi. Titik optimum tidak terdapat pada titik minimum karena pada grafik titik minimum terjadi pada saat perlakuan 1 dan 5 dimana perbandingan molnya berturut-turut adalah 1:5 dan 5:1. Hasil tersebut tidak sesuai dengan koefisien reaksi setara yaitu 2:1.
Untuk menentukan hasil reaksi berdasarkan konsep mol, dapat dihitung menggunakan rumus rendemen. Rumus persentase hasil ini memerlukan massa secara teori dan massa secara percobaan. Untuk memperoleh massa teori, dapat menggunakan massa dari endapan yang terbentuk dari reaksi NaOH dengan CuSO4 yaitu Cu(OH)2. Untuk memperoleh massa sebenarnya dapat melalui percobaan dan mengukur massa endapan yang terbentuk dari campuran NaOH dengan CuSO4 menggunakan mistar. Setelah diperoleh massa teori dan massa percobaan maka dapat dihitung persentase hasil dengan menggunakan rumus.
Pada percobaan stoikiometri reaksi pengendapan, diperoleh hasil persentase hasil yang berbeda-beda. Pada perlakuan pertama diperoleh persentase hasil sebesar 181,33%. Pada perlakuan kedua diperoleh persentase sebesar 168,82%. Pada perlakuan ketiga diperoleh persentase hasil sebesar 61,4%. Pada perlakuan keempat diperoleh persentase hasil sebesar 85,43%. Pada perlakuan kelima diperoleh persentase hasil sebesar 80,615%. Pada percobaan ini, terdapat persentase hasil yang lebih dari 100% dan kurang dari 100%. Untuk persentase hasil yang lebih dari 100% dikarenakan massa percobaan lebih besar dari pada massa teori. Hal ini dikarenakan perbedaan berat reaktan yang tidak tepat atau produk yang tercampur dengan air. Untuk persentase hasil yang kurang dari 100% dikarenakan massa percobaan lebih kecil dari pada massa teori. Hal terjadi karena beberapa produk atau reaktan yang hilang selama penyaringan berlangsung atau perpindahan dari satu wadah ke wadah lain yang menyebabkan berkurangnya berat suatu produk atau reaktan.
G. Kesimpulan
Berdasarkan percobaan yang telah dilakukan dapat disimpulkan bahwa:
1. Koefisien reaksi dapat ditentukan berdasarkan perubahan temperatur dan pembentukan endapan
a. Koefisien reaksi asam basa
NaOH(aq) + HCl(aq) -> NaCl(aq) + H2O(l)
Perbandingan mol = perbandingan koefisien
nNaOH : nHCl = koefisien NaOH : koefisien HCl
1 : 1 = 1 : 1
b. Koefisien reaksi pengendapan
2NaOH(aq) + CuSO4(aq) -> Na2SO4(aq) + Cu(OH)2(s)
Perbandingan mol = perbandingan koefisien
NNaOH : nCuSO4 = koefisien NaOH : koefisien CuSO4
2 : 1 = 2 : 1
Jadi, koefisien reaksi pengendapan adalah 2:1.
2. Hasil stoikiometri reaksi pengendapan menghasilkan massa teori sebesar 97,5x10-3 gram dan rendemen sebesar 85,43%.
H. Daftar Pustaka
- Chang, R. 2003. Kimia Dasar Jilid I. Jakarta: Erlangga.
- Keenan, Charles. 1980. Ilmu Kimia untuk Universitas. Jakarta: Erlangga.
- Petrucci, Ralph. 1985. Kimia Dasar Prinsip dan Terapan Modern. Jakarta: Erlangga.
Lampiran
Perhitungan Stoikiometri Reaksi Asam-Basa
= 1,0M x 15.10-3 L
= 15.10-3 mol
c. Mol titik optimum HCl
d. Perbandingan mol NaOH dan mol HCl
15.10-3 mol : 15.10-3 mol
1 : 1
e. Persamaan reaksi
a. 5 mL NaOH 1,0M dan 25 mL HCl 1,0M
= M x V
= 1,0M x 5.10-3 L
= 5.10-3 mol
- Mol HCl
= M x V
= 1,0M x 25.10-3 L
= 25.10-3 mol
|
|
NaOH |
+ |
HCl |
-> |
NaCl |
+ |
H2O |
|
M |
5.10-3 |
|
25.10-3 |
|
- |
|
|
|
R |
5.10-3 |
|
5.10-3 |
|
5.10-3 |
|
5.10-3 |
|
S |
- |
|
20.10-3 |
|
5.10-3 |
|
5.10-3 |
Pereaksi pembatas: NaOH
Pereaksi sisa: HCl
b. 10 mL NaOH 1,0M dan 20 mL HCl 1,0M
= M x V
= 1,0M x 1.10-2 L
= 1.10-2 mol
-Mol HCl
= M x V
= 1,0M x 2.10-2 L
= 2.10-2 mol
|
|
NaOH |
+ |
HCl |
-> |
NaCl |
+ |
H2O |
|
M |
1.10-2 |
|
2.10-2 |
|
- |
|
|
|
R |
1.10-2 |
|
1.10-2 |
|
1.10-2 |
|
1.10-2 |
|
S |
- |
|
1.10-2 |
|
1.10-2 |
|
1.10-2 |
Pereaksi pembatas: NaOH
Pereaksi sisa: HCl
c. 15 mL NaOH 1,0M dan 15 mL HCl 1,0M
-Mol NaOH
= M x V
= 1,0M x 15.10-3 L
= 15.10-3 mol
-Mol HCl
= M x V
= 1,0M x 15.10-3 L
= 15.10-3 mol
|
|
NaOH |
+ |
HCl |
-> |
NaCl |
+ |
H2O |
|
M |
15.10-3 |
|
15.10-3 |
|
- |
|
- |
|
R |
15.10-3 |
|
15.10-3 |
|
15.10-3 |
|
15.10-3 |
|
S |
- |
|
- |
|
15.10-3 |
|
15.10-3 |
Pereaksi pembatas: -
Pereaksi sisa: -
d. 20 mL NaOH 1,0M dan 10 mL HCl 1,0M
-Mol NaOH
= M x V
= 1,0M x 2.10-2 L
= 2.10-2 mol
-Mol HCl
= M x V
= 1,0M x 1.10-2 L
= 1.10-2 mol
|
|
NaOH |
+ |
HCl |
-> |
NaCl |
+ |
H2O |
|
M |
2.10-2 |
|
1.10-2 |
|
- |
|
- |
|
R |
1.10-2 |
|
1.10-2 |
|
1.10-2 |
|
1.10-2 |
|
S |
1.10-2 |
|
- |
|
1.10-2 |
|
1.10-2 |
Pereaksi pembatas: HCl
Pereaksi sisa: NaOH
e. 25 mL NaOH 1,0M dan 5 mL HCl 1,0M
-Mol NaOH
= M x V
= 1,0M x 25.10-3 L
= 25.10-3 mol
-Mol HCl
= M x V
= 1,0M x 5.10-3 L
= 5.10-3 mol
| NaOH | + | HCl | -> | NaCl | + | H2O |
M | 25.10-3 |
| 5.10-3 |
| - |
| - |
R | 5.10-3 |
| 5.10-3 |
| 5.10-3 |
| 5.10-3 |
S | 20.10-3 |
|
- |
|
5.10-3 |
|
5.10-3 |
Pereaksi pembatas: HCl
Pereaksi sisa: NaOH
Perhitungan Stoikiometri Reaksi Pengendapan
a. Titik optimum
20 mL NaOH 0,1M dan 10 mL CuSO4 0,1M
b. Mol titik optimum NaOH
= M NaOH x V NaOH
= 10-1 M x 2.10-2 L
= 2.10-3 mol
c. Mol titik optimum CuSO4
= M CuSO4 x V CuSO4
= 10-1 M x 2.10-2 L
= 15.10-3 mol
d. Perbandingan mol NaOH dan mol CuSO4
mol NaOH : mol HCl
15.10-3 mol : 15.10-3 mol
1 : 1
e. Persamaan reaksi
2NaOH(aq) + CuSO4(aq) -> Na2SO4(aq) + Cu(OH)2(s)
a. 5 mL NaOH 0,1M dan 25 mL CuSO4 0,1M
-Mol NaOH
= M x V
= 10-1 M x 5.10-3 L
= 5.10-4 mol
-Mol CuSO4
= M x V
= 10-1 M x 25.10-3 L
= 25.10-4 mol
|
|
2NaOH |
+ |
CuSO4 |
-> |
Cu(OH)2 |
+ |
Na2SO4 |
|
M |
5.10-4 |
|
25.10-4 |
|
- |
|
- |
|
R |
5.10-4 |
|
2,5.10-4 |
|
2,5.10-4 |
|
2,5.10-4 |
|
S |
- |
|
22,5.10-4 |
|
2,5.10-4 |
|
2,5.10-4 |
Pereaksi pembatas: NaOH
Pereaksi sisa: CuSO4
-Massa Cu(OH)2
= mol x Mr
= 2,5.10-4 mol x 97,5 g/mol
= 243,75. 10-4 gram
= 0,0243 gram
-Rendemen
= (massa percobaan : massa teori) x 100%
= (0,0442 gram : 0,0243 gram) x 100%
= 181,33%
b. 10 mL NaOH 0,1M dan 20 mL CuSO4 0,1M
-Mol NaOH
= M x V
= 10-1 M x 1.10-2 L
= 1.10-3 mol
-Mol CuSO4
= M x V
= 10-1 M x 2.10-2 L
= 2.10-3 mol
|
|
2NaOH |
+ |
CuSO4 |
-> |
Cu(OH)2 |
+ |
Na2SO4 |
|
M |
1.10-3 |
|
2.10-3 |
|
- |
|
- |
|
R |
1.10-3 |
|
0,5.10-3 |
|
0,5.10-3 |
|
0,5.10-3 |
|
S |
- |
|
1,5.10-3 |
|
0,5.10-3 |
|
0,5.10-3 |
Pereaksi pembatas: NaOH
Pereaksi sisa: CuSO4
-Massa Cu(OH)2
= mol x Mr
= 0,5.10-3 mol x 97,5 g/mol
= 48,75. 10-4 gram
= 0,0487 gram
-Rendemen
= (massa percobaan : massa teori) x 100%
= (0,0823 gram : 0,0487 gram) x 100%
= 168,82%
c. 15 mL NaOH 0,1M dan 15 mL CuSO4 0,1M
-Mol NaOH
= M x V
= 10-1 M x 15.10-3 L
= 15.10-4 mol
-Mol CuSO4
= M x V
= 10-1 M x 15.10-3 L
= 15.10-4 mol
|
|
2NaOH |
+ |
CuSO4 |
-> |
Cu(OH)2 |
+ |
Na2SO4 |
|
M |
15.10-4 |
|
15.10-4 |
|
- |
|
- |
|
R |
15.10-4 |
|
8,5.10-4 |
|
7,5.10-4 |
|
7,5.10-4 |
|
S |
- |
|
7,5.10-4 |
|
7,5.10-4 |
|
7,5.10-4 |
Pereaksi pembatas: NaOH
Pereaksi sisa: CuSO4
-Massa Cu(OH)2
= mol x Mr
= 7,5.10-4 mol x 97,5 g/mol
= 731,25. 10-4 gram
= 0,0731 gram
-Rendemen
= (massa percobaan : massa teori) x 100%
= (0,0449 gram : 0,0731 gram) x 100%
= 61,4%
d. 20 mL NaOH 0,1M dan 10 mL CuSO4 0,1M
-Mol NaOH
= M x V
= 10-1 M x 2.10-2 L
= 2.10-3 mol
-Mol CuSO4
= M x V
= 10-1 M x 1.10-2 L
= 1.10-3 mol
|
|
2NaOH |
+ |
CuSO4 |
-> |
Cu(OH)2 |
+ |
Na2SO4 |
|
M |
2.10-3 |
|
1.10-3 |
|
- |
|
- |
|
R |
2.10-3 |
|
1.10-3 |
|
1.10-3 |
|
1.10-3 |
|
S |
- |
|
- |
|
1.10-3 |
|
1.10-3 |
Pereaksi pembatas: -
Pereaksi sisa: -
-Massa Cu(OH)2
= mol x Mr
= 1.10-3 mol x 97,5 g/mol
= 97,5. 10-3 gram
= 0,0975 gram
-Rendemen
= (massa percobaan : massa teori) x 100%
= (0,0833 gram : 0,0975 gram) x 100%
= 85,43%
e. 25 mL NaOH 0,1M dan 5 mL CuSO4 0,1M
-Mol NaOH
= M x V
= 10-1 M x 25.10-3 L
= 25.10-4 mol
-Mol CuSO4
= M x V
= 10-1 M x 5.10-3 L
= 5.10-4 mol
|
|
2NaOH |
+ |
CuSO4 |
-> |
Cu(OH)2 |
+ |
Na2SO4 |
|
M |
25.10-4 |
|
5.10-4 |
|
- |
|
- |
|
R |
10.10-4 |
|
5.10-4 |
|
5.10-4 |
|
5.10-4 |
|
S |
15.10-4 |
|
- |
|
5.10-4 |
|
5.10-4 |
Pereaksi pembatas: CuSO4
Pereaksi sisa: NaOH
-Massa Cu(OH)2
= mol x Mr
= 5.10-4 mol x 97,5 g/mol
= 487,5. 10-4 gram
= 0,0487 gram
-Rendemen
= (massa percobaan : massa teori) x 100%
= (0,0393 gram : 0,0487 gram) x 100%
= 80,615%
Posting Komentar untuk "Laporan Praktikum Stoikiometri Reaksi Asam-Basa dan Pengendapan"