Laporan Praktikum Kinetika Reaksi Asam Klorida dan Magnesium
Praktikum berjudul kinetika reaksi asam klorida dan magnesium bertujuan untuk memahami dan menentukan orde reaksi serta menentukan pengaruh konsentrasi terhadap laju reaksi. Prinsip kerja pada percobaan ini adalah pengenceran dan laju reaksi.
“KINETIKA REAKSI ASAM KLORIDA DAN MAGNESIUM”
A. Tujuan
- Memahami apa yang dimaksud dengan tingkat/orde reaksi.
- Menentukan orde reaksi dari data percobaan
- Memahami cara menentukan pengaruh konsentrasi terhadap laju reaksi.
B. Dasar Teori
1. Kinetika Reaksi
Kinektika kimia merupakan bidang kimia yang mengkaji kecepatan (laju) dan terjadinya reaksi kimia. Kata kinetik berarti gerakan atau perubahan. Kinetika reaksi adalah jumlah mol zat yang bereaksi per liter yang diubah menjadi zat lain dalam suatu satuan waktu tertentu. Laju reaksi merupakan perubahan konsentrasi reaktan atau produk terhadap waktu (M/s). Setiap reaksi dapat dinyatakan dengan persamaan umum:
reaktan → produk
Persamaan tersebut menyatakan bahwa selama berlangsungnya suatu reaksi, molekul reaktan bereaksi sedangkan molekul produk terbentuk. Sebagai hasilnya, dapat diamati jalannya reaksi dengan mengamati menurunnya konsentrasi reaktan atau meningkatnya konsentrasi produk (Chang, 2004).
2. Laju Reaksi
Laju reaksi suatu reaksi kimia dinyatakan sebagai fungsi konsentrasi zat-zat pereaksi yang berperan serta dalam reaksi tersebut. Satuan laju reaksi adalah mol/L atau atm/s. Hukum laju merupakan persamaan yang mengaitkan laju reaksi dengan konsentrasi molar atau tekanan parsial pereaksi dengan pangkat yang sesuai. Persamaan laju dinyatakan dengan bentuk diferensial atau bentuk integral. Sehingga mekanisme penentuan laju harus ditentukan secara percobaan (Hiskia, 1992).
Untuk reaksi aA+bB dapat diperoleh bahwa laju reaksi dapat berbanding lurus dengan [A]x dan [B]y, ungkapan untuk laju reaksi yaitu:
ѵ = k[A]x . [B]y
Keterangan:
- v: laju reaksi
- k: tetapan laju reaksi
- [A]: konsentrasi zat pereaksi A (M)
- [B]: konsentrasi zat pereaksi B (M)
- x: orde reaksi zat A
- y: orde reaksi zat B
x dan y merupakan bilangan bulat, pecahan, atau nol. Sedangkan x+y merupakan orde reaksi keseluruhan (Hiskia, 1992).
Menurut hukum kegiatan massa, kecepatan reaksi pada temperatur tetap berbanding lurus dengan konsentrasi pengikut-pengikut ketiga dan masing-masing berpangkat sebanyak molekul dalam persamaan reaksi. Jumlah molekul yang ikut dalam reaksi disebut molekul anitas. Jumlah molekul pereaksi yang konsentrasinya menentukan kecepatan reaksi disebut tingkat reaksi (Sukardjo, 1989).
Laju reaksi secara mendasar tergantung pada beberapa faktor antara lain:
a. Konsentrasi Reaktan
Konsentrasi reaktan yang dinaikkan biasanya membuat reaksi berjalan lebih cepat. Hal tersebut diakibatkan karena peningkatan pertumbukan atom persatuan waktu. Semakin banyak konsentrasi ditambahkan maka semakin besar peluang bertumbukan.
b. Luas Permukaan
Luas permukaan yang tersedia bagi reaktan untuk saling berinteraksi terutama reaktan padat dalam sistem heterogen. Luas permukaan yang besar akan meningkatkan laju reaksi.
c. Tekanan
Meningkatnya tekanan menurunkan volume antar molekul sehingga akan meningkatkan laju reaksi.
d. Energi Aktivasi
Energi aktivasi yang lebih tinggi mengimplikasikan bahwa reaktan memerlukan lebih banyak energi untuk memulai reaksi daripada reaksi yang berenergi aktivasi rendah.
e. Temperatur
Laju reaksi bertambah dengan naiknya temperatur. Biasanya kenaikan sebesar 10oC akan melipatkan dua atau tiga laju reaksi antara molekul. Pada temperatur tinggi, molekul lebih sering bertumbukan. Hampir semua reaksi menjadi lebih cepat bila suhu dinaikkan karena kalor akan menambah energi kinetik partikel pereaksi.
f. Katalis
Katalis adalah zat yang ditambahkan ke dalam reaksi agar mempercepat jalannya reaksi. Katalis biasanya ikut bereaksi sementara dan kemudian terbentuk kembali sebagai zat bebas (Sunarya, 2002).
3. Orde Reaksi
Orde reaksi merupakan jumlah satu eksponen yang menyatakan hubungan antara konsentrasi dengan ketepatan reaksi. Untuk reaksi umum A+B→C, maka kecepatan reaksi oleh konsentrasi A dan B. orde reaksi total yang perlu diperhatikan adalah:
a. Data eksperimen harus pada suhu konstan agar harga v tetap
b. Metode dalam mencari orde reaksi yaitu metode logika daan metode perbandingan
Orde reaksi dapat dicari dengan menggunakan metode grafik. Apabila berupa garis lengkung (parabola) merupakan reaksi orde dua. Jika garis lurus (linier) merupakan orde satu. Macam-macam orde reaksi antara lain:
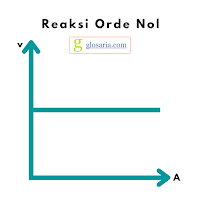
a. Reaksi orde nol (0)
Reaksi orde nol mempunyai laju yang tidak bergantung pada konsentrasi larutan. Hanya reaksi heterogen yang mempunyai hukum laju dengan orde nol secara keseluruhan. Rumus laju reaksi orde nol sebagai berikut:
v = k [A]0
Grafik reaksi orde nol sebagai berikut:
b. Reaksi orde satu (1)
Jika laju suatu reaksi kimia berlangsung lurus dengan konsentrasi maka reaksi tersebut dikatakan sebagai reaksi orde satu atau tingkat pertama. Rumus laju reaksi orde satu sebagai berikut:
v = k [A]1
Grafik reaksi orde satu sebagai berikut:
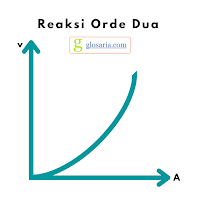
c. Reaksi orde dua (2)
Jika laju reaksi sebanding dengan pangkat dua suatu pereaksi atau pangkat satu konsentrasi dua pereaksi, maka reaksi tersebut merupakan reaksi orde dua. Jika dinyatakan dalam grafik, maka laju reaksi dengan orde dua berupa garis lengkung. Jika konsentrasinya dinaikkan 2 kali maka laju reaksi akan meningkat 22 atau 4 kalinya. Jika dinaikkan 3 kali menjadi 32 atau 9 kali dan seterusnya. Rumus laju reaksi orde dua sebagai berikut:
v = k [A]2
Grafik reaksi orde dua sebagai berikut:
4. Konstanta k
Koefisien k disertai konsentrasinya yang tidak bergantung pada konsentrasi, tetapi bergantung pada temperatur. Persamaan sejenis ini yang ditentukan secara eksperimen disebut hukum laju reaksi. Secara formal hukum laju reaksi adalah persamaan yang menyamakan laju reaksi sebagai fungsi dari konsentrasi semua yang ada termasuk produknya (Susila, 2003). Konstanta k dapat diketahui dengan dua cara antara lain:
a. Persamaan Hukum Laju
Persamaan hukum laju dapat digunakan untuk menentukan harga k dengan menggambar grafik In [A] versus t2 sehingga diperoleh gradien atau tgα yaitu k dengan intersep In A.
b. Persamaan Archenius
Hubungan antara laju reaksi dengan temperatur dinyatakan dalam persamaan sebagai berikut:
In k = In A - (Ea/RT)
Keterangan:
- k: konstanta laju reaksi
- A: konstanta archenius
- Ea: energi aktivasi
- R: tetapan gas umum
- T: temperatur mutlak
C. Alat dan Bahan
Alat-alat yang digunakan pada percobaan ini adalah erlenmeyer, gelas beaker, pipet ukur, buret, statif, klem, pipet tetes, corong, amplas, stopwatch, bola hisap, label, dan botol akuades. Bahan-bahan yang digunakan pada percobaan ini adalah larutan HCl, pita magnesium, dan akuades.
D. Cara Kerja
Percobaan pertama yaitu menentukan orde reaksi HCl dengan cara menyiapkan akuades dalam buret, HCl dalam gelas beaker, dan pita magnesium yang telah diamplas. Langkah selanjutnya yaitu mencampurkan HCl dan akuades dalam erlenmeyer. Kemudian dimasukkan pita magnesium dengan ukuran yang sama. Dihitung waktunya menggunakan stopwatch hingga pita magnesium habis. Kemudian dihitung konsentrasi HCl dan ditentukan orde reaksi serta dibuat grafiknya. Variasi yang dibutuhkan:
- 10 mL HCl + 1 cm pita Mg
- 8 mL HCl + 2 mL akuades + 1 cm pita Mg
- 6 mL HCl + 4 mL akuades + 1 cm pita Mg
- 4 mL HCl + 6 mL akuades + 1 cm pita Mg
- 2 mL HCl + 8 mL akuades + 1 cm pita Mg
Percobaan kedua yaitu menyiapkan akuades dalam buret, HCl dalam gelas beaker, dan pita magnesium yang telah diamplas. Langkah selanjutnya yaitu mencampurkan HCl dan akuades yang volumenya dibuat sama ke dalam erlenmeyer. Kemudian dimasukkan pita magnesium dengan berbagai ukuran. Dihitung waktunya menggunakan stopwatch hingga pita magnesium habis. Variasi yang dibutuhkan:
- 5 mL HCl + 5 mL akuades + 1 cm pita Mg
- 5 mL HCl + 5 mL akuades + 2 cm pita Mg
- 5 mL HCl + 5 mL akuades + 3 cm pita Mg
- 5 mL HCl + 5 mL akuades + 4 cm pita Mg
- 5 mL HCl + 5 mL akuades + 5 cm pita Mg
E. Data Hasil Pengamatan
1. Konsentrasi HCl dengan variasi volume
|
Volume (mL) |
Molaritas |
M2 HCl |
t (s) |
1/t (s-1) |
|
|
HCL |
H2O |
||||
|
10 |
0 |
2 |
4 |
18 |
5,6.10-3 |
|
8 |
2 |
1,6 |
2,56 |
61 |
1,6.10-3 |
|
6 |
4 |
1,2 |
1,44 |
77 |
1,3.10-3 |
|
4 |
6 |
0,8 |
0,64 |
230 |
4,3.10-4 |
|
2 |
8 |
0,4 |
0,16 |
1465 |
6,82.10-5 |
2. Variasi panjang pita Mg dengan volume dibuat tetap
|
Panjang Mg (cm) |
Molaritas (M) |
Keterangan |
t (s) |
|
1 |
1 |
Gelembung gas H2 |
268 |
|
2 |
1 |
Gelembung gas H2 |
110 |
|
3 |
1 |
Gelembung gas H2 |
170 |
|
4 |
1 |
Gelembung gas H2 |
534 |
|
5 |
1 |
Gelembung gas H2 |
388 |
F. Pembahasan
Percobaan yang dilakukan berjudul Kinetika Reaksi Asam Klorida dan Magnesium. Tujuan dari percobaan ini adalah memahami tingkat/orde reaksi, menentukan orde reaksi dari data percobaan, dan memahami cara menentukan pengaruh konsentrasi terhadap laju reaksi. Prinsip kerja pada percobaan ini adalah pengenceran dan laju reaksi.
Pengenceran merupakan proses merubah zat yang konsentrasinya tinggi menjadi zat yang konsentrasinya rendah dengan menambahkan pelarut berlebih pada larutan. Pengenceran dilakukan untuk menjadikan larutan menjadi bervariasi volume zat pelarut dan terlarut. Hasil pengenceran juga digunakan dalam pembuatan grafik untuk penentuan laju reaksi. Sehingga konsentrasi yang didapatkan dari pengenceran sangat mempengaruhi orde reaksi.
Percobaan pertama yang dilakukan yaitu menentukan orde reaksi HCl. Langkah pertama yaitu dengan mencampurkan HCl dengan akuades. Penambahan akuades dilakukan semakin banyak sehingga larutan HCl semakin encer pada percobaan kelima. Setelah larutan siap, pita magnesium sepanjang 1 cm dimasukkan secara bersamaan dengan dihitungnya waktu reaksi. Waktu yang dibutuhkan untuk bereaksi dan habisnya pita magnesium sangat cepat terhadap konsentrasi larutan HCl yang tertinggi.
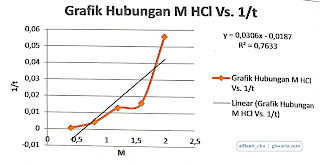
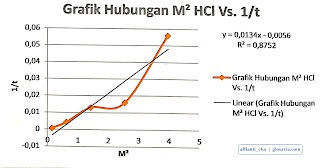
Berdasarkan grafik yang dibuat dari hubungan antara konsentrasi HCl dan 1/t didapat nilai R2 sebesar 0,7633. Grafik hubungan antara [HCl]2 dan 1/t didapat nilai R2 sebesar 0,8752. Sehingga orde reaksi terhadap HCl adalah orde reaksi tingkat 2 dari pendekatan nilai R2.
Percobaan kedua yang dilakukan yaitu mencampurkan larutan HCl dengan akuades menggunakan volume sama banyak. Kemudian dimasukkan pita magnesium dengan berbagai ukuran. Data yang dihasilkan menunjukkan bahwa semakin besar luas permukaannya maka waktu reaksinya semakin lama. Pita magnesium yang direaksikan dengan larutan HCl menghasilkan gelembung gas di sekitar pita magnesium. Gelembung gas yang dihasilkan dari reaksi antara pita magnesium dengan larutan HCl adalah gas hidrogen (H2). Persamaan reaksi yang terjadi sebagai berikut:
Mg(s) + 2HCl(aq) → MgCl2(aq) + H2(g)
G. Kesimpulan
Berdasarkan percobaan Kinetika Reaksi Asam Klorida dan Magnesium dapat disimpulkan bahwa:
- Orde reaksi adalah jumlah pangkat dari semua konsentrasi reaktan yang muncul dalam hukum laju.
- Orde reaksi HCl adalah 2.
- Pengaruh konsentrasi terhadap laju reaksi yaitu semakin besar konsentrasi suatu larutan maka semakin cepat waktu reaksi sehingga semakin cepat pula laju reaksinya.
H. Daftar Pustaka
- Chang, R. 2004. Kimia Dasar: Konsep-konsep Inti Jilid 2. Jakarta: Erlangga.
- Hiskia, A. 1992. Elektrokimia dan Kinetika Kimia. Bandung: ITB.
- Khopkar, S. M. 1990. Konsep Dasar Kimia Analitik. Jakarta: UI Press.
- Sukardjo. 1989. Kimia Fisika. Yogyakarta: Rineka Cipta.


Posting Komentar untuk "Laporan Praktikum Kinetika Reaksi Asam Klorida dan Magnesium"