Laporan Praktikum Sintesis dan Penentuan Rumus Molekul Senyawa Kompleks Besi (II) Oksalat
Percobaan berjudul Sintesis dan Penentuan Rumus Molekul Senyawa Kompleks Besi (II) Oksalat bertujuan untuk mensintesis senyawa kompleks besi (II) oksalat dan menentukan rumus molekul senyawa kompleks besi (II) oksalat. Prinsip kerja dari percobaan ini adalah struktur senyawa koordinasi, dimana terjadi transfer elektron antara ligan dengan ion logam.
“SINTESIS DAN PENENTUAN RUMUS MOLEKUL SENYAWA KOMPLEKS BESI (II) OKSALAT”
A. Tujuan
- Mensintesis senyawa kompleks besi (II) oksalat
- Menentukan rumus molekul senyawa kompleks besi (II) oksalat
B. Dasar Teori
1. Rumus Molekul
Rumus molekul merupakan rumus kimia yang memberikan informasi secara tepat tentang jenis unsur pembentuk satu molekul senyawa dan jumlah atom masing-masing unsur. Misalnya satu molekul senyawa glukosa dengan rumus molekul C6H1206 tersusun atas unsur karbon, hidrogen, dan oksigen. Banyaknya atom penyusun satu molekul glukosa adalah 6 atom karbon (C), 12 atom hidrogen (H), dan 6 atom oksigen (O) (Rivai, 1994).
2. Senyawa Kompleks
Senyawa kompleks merupakan senyawa yang terdiri dari satu atom pusat atau lebih yang menerima sumbangan pasangan elektron dari atom lain. Gugus atom penyumbang elektron ini disebut ligan (Pudyaatmaka, 2002).
Senyawa kompleks merupakan jenis senyawa yang molekul atau ionnya dapat membentuk ikatan koordinasi dengan atom logan atau ion. Spesies koordinasi (ligan) memiliki pasangan elektron bebas yang dapat disumbangkan untuk logam atom atau ion lainnya, seperti ion amonia atau air atau ion negatif seperti Cl- atau CN-. Kompleks yang dihasilkan mungkin netral atau menjadi ion kompleks (Daintith, 2004).
3. Ligan
Senyawa ion logam yang berkoordinasi dengan ligan disebut dengan senyawa kompleks. Sebagian besar ligan merupakan zat netral atau anionic tetapi kation seperti kation tropilium juga dikenal sebagai ligan. Ligan netral seperti amonia (NH3) atau karbon monoksida (CO2) dalam keadaan bebas merupakan molekul yang stabil, sementara ligan anionic seperti Cl- atau C5H5- distabilkan hanya jika dikoordinasikan ke atom logam pusat. Ligan representatif menurut unsur yang mengikatnya. Ligan umum atau dengan rumus kimia rumit diungkapkan dengan singkatanyya (Saito, 1996).
Ligan seperti I-, NH3, CN- hanya memiliki satu atom donor pasangan elektron dan disebut monodentate. Ligan yang mempunyai atom donor lebih dari satu disebut multidentate, pentadentate, dan seterusnya bila mempunyai atom donor pasangan elektron sebanyak 3, 4, 5, 6. Contoh ligan bidentat adalah etilena diamin yang memiliki dua atom donor yaitu kedua atom N dan 8-hidroksikuinolin (oksin). Sedangkan ligan polidentat contohnya adalah EDTA yang memiliki enam buah atom donor pasangan elektron yaitu melalui kedua atom N dan keempat atom O (dari OH) (Harjadi, 1990).
4. Titrasi Permanganometri
Permanganometri merupakan metode titrasi dengan menggunakan kalium permanganat yang merupakan oksidator kuat sebagai titran. Titrasi ini didasarkan atas titrasi reduksi dan oksidasi atau redoks. Kalium permanganat telah digunakan sebagai pengoksida secara meluas lebih dari 100 tahun. Reagensia ini mudah diperoleh, murah, dan tidak memerlukan indikator kecuali bila digunakan larutan yang sangat encer. Permanganat bereaksi secara beraneka, karena mangan dapat memiliki keadaan oksidasi +2, +3, +4, +6, dan +7 (Day dan Underwood, 2002).
5. Kristalisasi
Kristalisasi adalah metode pemisahan dengan cara pembentukan kristal sehingga campuran dapat dipisahkan. Suatu zat gas dan cair dapat didinginkan atau memadat serta membentuk kristal karena mengalami proses kristalisasi. Kristal-kristal juga akan terbentuk dari suatu larutan yang akan dijenuhkan dengan pelarut tertentu. Semakin banyak kristalnya, maka semakin baik karena semakin kecil kemungkinan tercemar oleh kotoran (Arsyad, 2001).
Adapun proses kristalisasi dapat dilakukan dengan cara sebagai berikut:
a. Kristalisasi dengan Penguapan
Kelarutan suatu bahan yang berkurang sedikit demi sedikit dengan menurunnya suhu. Kondisi lewat jenuhnya dapat dipakai dengan penguapan sebagai pelarut.
b. Kristalisasi dengan Pendinginan
Kelarutan suatu bahan yang berkurang drastis dengan menurunnya suhu. Kondisi lewat jenuh dicapai dengan pendinginan larutan panas yang jenuh. Untuk mengkristalisasi dari lelehan dapat juga dilakukan (Cahyono, 1991).
C. Alat dan Bahan
Alat-alat yang digunakan pada percobaan ini adalah gelas beaker, gelas ukur, erlenmeyer, buret, gelas arloji, sendok sungu, neraca analitik, termometer, hot plate, corong buchner, glass wool, kertas saring, statif, klem, label, dan botol akuades.
Bahan-bahan yang digunakan pada percobaan ini adalah ammonium besi (II) sulfat, serbuk seng, kalium permanganat 0,02M, asam sulfat 2M, kristal asam oksalat, dan akuades.
D. Cara Kerja
Langkah pertama yang dilakukan yaitu ammonium besi (II) sulfat ditimbang sebanyak 4 gram. Kemudian dilarutkan dalam 12,5 mL akuades yang telah diasamkan dengan 0,5 mL asam sulfat 2M.
Langkah kedua yang dilakukan yaitu kristal asam oksalat ditimbang sebanyak 2,5 gram. Kemudian dilarutkan dalam 15 mL akuades.
Langkah ketiga yang dilakukan yaitu larutan ammonium besi (II) sulfat dicampurkan dengan larutan asam oksalat. Kemudian campuran didihkan menggunakan hot plate hingga terbentuk endapan kuning. Endapan disaring menggunakan corong buchner dan dicuci dengan air panas dan aseton. Endapan yang dihasilkan dikeringkan.
Langkah terakhir yang dilakukan yaitu endapan kering sebanyak 0,2 gram dilarutkan dengan asam sulfat 2M. Kemudian dititrasi dengan larutan standar kalium permanganat. Jika warna kalium permanganat pudar, dipanaskan sampai suhu 60oC lalu titrasi kembali hingga mencapai titik ekuivalen. Selanjutnya ditambahkan 2 gram serbuk seng sambil diaduk selamat 10 menit kemudian disaring dengan glass wool. Residu yang tertinggal dicuci dengan asam sulfat 2M. Filtrat dititrasi menggunakan kalium permanganat hingga mencapai titik ekuivalen.
E. Data Hasil Pengamatan
|
No. |
Cara Kerja |
Pengamatan |
|
1. |
Amonium besi (II) sulfat dilarutkan dalam akuades yang telah diasamkan dengan asam sulfat |
Larutan berwarna hijau kebiruan Massa = 4,0238 gram |
|
2. |
Kristal asam oksalat dilarutkan dalam akuades |
Larut Massa = 2,5081 gram |
|
3. |
Larutan ammonium besi (II) sulfat ditambahkan dengan larutan asam oksalat |
Larutan berubah warna menjadi kuning dan terbentuk endapan |
|
4. |
Campuran didihkan |
Terbentuk endapan kuning |
|
5. |
Endapan disaring, dicuci dengan air panas, dicuci dengan aseton, dan dikeringkan |
Massa endapan = 1,9763 gram |
|
6. |
Endapan kering dilarutkan dalam asam sulfat |
Massa = 0,203 gram |
|
7. |
Larutan dititrasi dengan larutan standar kalium permanganat |
Volume titrasi = 1,3 mL Larutan berwarna kuning |
|
8. |
Jika warna larutan kalium permanganat pudar, dipanaskan sampai suhu 60oC dan dilanjutkan titrasi |
Volume titrasi (V1) = 34,45 mL Larutan berwarna merah muda |
|
9. |
Larutan ditambahkan serbuk seng dan diaduk selama 10 menit |
Massa = 2,0341 gram Larutan berwarna abu-abu, terdapat gelembung gas, dan berasap |
|
10. |
Larutan disaring dengan glass wool |
Larutan tidak berwarna, berasap |
|
11. |
Residu dicuci dengan asam sulfat |
|
|
12. |
Dititrasi dengan kalium permanganat |
Volume titrasi (V2) = 11,65 mL Larutan berwarna merah muda keunguan |
F. Pembahasan
Percobaan yang dilakukan berjudul “Sintesis dan Penentuan Rumus Molekul Senyawa Kompleks Besi (II) Oksalat”. Tujuan dari percobaan ini yaitu untuk mensintesis senyawa kompleks besi (II) oksalat dan menentukan rumus molekul senyawa kompleks besi (II) oksalat. Prinsip kerja dari percobaan ini adalah struktur senyawa koordinasi, dimana terjadi transfer elektron antara ligan dengan ion logam.
Prinsip kerja kedua yang digunakan adalah pembentukan senyawa kompleks besi (II) oksalat dengan cara titrasi reduksi oksidasi (redoks) yaitu menggunakan titrasi permanganometri. Titrasi dilakukan untuk mengetahui rumus senyawa kompleks dan rendemen yang dihasilkan. Pada percobaan ini titrasi redoks digunakan adalah titrasi permanganometri yaitu titrasi dimana larutan standar yang digunakan sebagai titran adalah larutan permanganat (KMnO4).
Sintesis senyawa kompleks besi (II) oksalat dilakukan dengan mereaksikan terlebih dahulu larutan ammonium besi (II) sulfat dengan larutan asam oksalat. Sebelum direaksikan, larutan ammonium besi (II) sulfat berwarna hijau kebiruan dan larutan asam oksalat tidak berwarna. Setelah direaksikan, campuran berubah warna menjadi kuning. Perubahan warna tersebut menunjukkan bahwa terjadinya senyawa kompleks baru dari hasil reaksi. Reaksi yang terjadi sebagai berikut:
[Fe(NH4)2(SO4)2.6H2O](aq) + [H2C2O4.2H2O](aq) → [Fe(C2O4)(H2O)]2+(aq)
Saat campuran didihkan, larutan menjadi keruh berwarna kuning dan terbentuk endapan yang berwarna kuning. Endapan tersebut merupakan padatan besi (II) oksalat. Pendidihan pada campuran tersebut bertujuan untuk menghasilkan endapan besi (II) oksalat dan memisahkan senyawa kompleks besi (II) oksalat dan pelarut air. Reaksi yang terjadi sebagai berikut:
[Fe(C2O4)(H2O)]2+(aq) → [Fe(C2O4)]2+(s) + H2O(aq)
Endapan yang dihasilkan kemudian disaring supaya senyawa kompleks besi (II) oksalat dan pelarut air benar-benar terpisah. Kemudian endapan dicuci menggunakan air panas. Pencucian endapan menggunakan air panas bertujuan untuk memisahkan endapan dari pengotor. Selanjutnya endapan dicuci menggunakan aseton bertujuan untuk memisahkan pengotor lain yang tidak terpisah saat pencucian menggunakan air panas.
Endapan kemudian dikeringkan bertujuan untuk menghilangkan molekul-molekul air yang masih terdapat dalam endapan senyawa kompleks besi (II) oksalat. Tujuan lain dari pengeringan yaitu untuk mengeringkan endapan besi (II) oksalat agar dapat dihitung massa endapannya dan menentukan rendemennya. Jika endapan besi (II) oksalat masih dalam keadaan basah, maka penimbangan tidak dapat dilakukan karena massa yang terukur dalam timbangan merupakan massa endapan besi (II) oksalat dengan pelarutnya (air). Rendemen yang dihasilkan dari percobaan ini sebesar 97,85%. Rendemen yang dihasilkan cukup besar dibuktikan dengan banyaknya endapan yang didapatkan. Banyaknya endapan dapat terjadi jika proses pengendapan berlangsung dengan cepat.
Sebagian endapan tersebut diambil kemudian dilarutkan dalam asam sulfat. Saat dilarutkan, endapan melarut dan larutan berwarna kuning pucat. Kemudian larutan dititrasi dengan larutan standar kalium permanganat. Titrasi yang dilakukan merupakan titrasi permanganometri. Permanganometri merupakan metode titrasi dengan menggunakan kalium permanganat yang merupakan oksidator kuat sebagai titran. Titrasi ini didasarkan atas titrasi reduksi dan oksidasi (redoks).
Titrasi tersebut tidak memerlukan indikator, kecuali bila larutan yang digunakan sangat encer. Warna larutan kalium permanganat adalah ungu. Saat titrasi mencapai titik ekuivalen, larutan yang semula berwarna kuning pucat berubah warna menjadi kuning pada volume titrasi 1,3 mL. saat warna mulai memucat, larutan tersebut dipanaskan sampai suhu 60oC. pemanasan dilakukan agar reaksi berlangsung dengan cepat.
Kemudian titrasi dilanjutkan sampai larutan berubah warna menjadi merah muda. Perubahan warna tersebut menunjukkan bahwa titrasi telah mencapai titik ekuivalen. Volume titrasi yang digunakan sebanyak 33,15 mL. Volume titrasi total yaitu 34,45 mL. Reaksi redoks yang berlangsung saat titrasi pertama sebagai berikut:
MnO4-(aq)
+ 8H+(aq) + 5e- → Mn2+(aq) + 4H2O(l)
x1
Fe2+(aq) → Fe3+(aq) + e- x5
MnO4-(aq) + 8H+(aq)
+ 5Fe2+(aq) → Mn2+(aq) + 4H2O(l)
+ 5Fe3+(aq)
Reaksi redoks yang berlangsung saat titrasi kedua sebagai berikut:
MnO4-(aq)
+ 8H+(aq) + 5e- → Mn2+(aq) + 4H2O(l) x2
C2O42-(aq) → 2CO2(g)
+ 2e- x5
2MnO4-(aq) + 16H+(aq)
+ 5C2O42-(aq) → 2Mn2+(aq)
+ 8H2O(l) + 10CO2(g)
Larutan kemudian ditambahkan serbuk seng dan diaduk selama 10 menit. Fungsi penambahan seng yaitu untuk mereduksi Fe3+ menjadi Fe2+ melalui reaksi redoks sebagai berikut:
Fe3+(aq)
+ e- → Fe2+(aq) x2
Zn(s) →
Zn2+(aq) + 2e- x1
2Fe3+(aq) + Zn(s) → 2Fe2+(aq)
+ Zn2+(aq)
Saat penambahan serbuk seng terdapat perubahan seperti gas, gelembung pada larutan, suhu meningkat, dan sebagian serbuk seng larut. Perubahan tersebut ditandai dengan larutan yang menjadi panas disebabkan karena larutan hasil titrasi masih panas disebabkan oleh pemanasan sebelumnya kemudian ditambahkan dengan serbuk seng yang memiliki konsentrasi tinggi. Panas yang dihasilkan merupakan hasil dari reaksi endoterm.
Campuran kemudian disaring menggunakan glass wool untuk meredamkan suara yang dihasilkan dari campuran tersebut. Residu yang dihasilkan berwarna hitam dan filtrat yang dihasilkan berwarna keabuan. Residu kemudian dicuci menggunakan asam sulfat bertujuan untuk mengikat Zn yang masih terbawa dan terpisah dari kompleks yang diinginkan. Filtrat yang dihasilkan kemudian dititrasi menggunakan kalium permanganat dengan volume titrasi 11,65 mL. titik ekuivalen ditandai dengan perubahan warna larutan menjadi ungu.
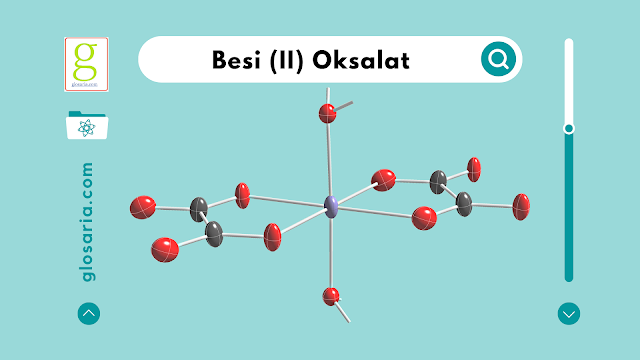
Senyawa kompleks besi (II) oksalat dapat disintesis dengan mereaksikan ammonium besi (II) sulfat dan asam oksalat disertai dengan pemanasan. Sehingga terbentuk endapan besi /9II) oksalat. Endapan besi (II) oksalat tersebut harus dicuci terlebih dahulu untuk menghilangkan pengotor-pengotornya. Rendemen yang didapatkan dari percobaan sebesar 97,85%. Rumus molekul senyawa yang didapatkan yaitu [Fe(C2O4)(H2O)2].
G. Kesimpulan
Berdasarkan percobaan yang telah dilakukan dapat disimpulkan bahwa:
1. Senyawa besi (II) oksalat dapat disintesis
dengan mereaksikan (NH4)2Fe(SO4)2,6H2O
dengan H2C2O4.2H2O. Persamaan
reaksi yang terjadi:
[Fe(NH4)2(SO4)2.6H2O](aq)
+ [H2C2O4.2H2O](aq)
→ [Fe(C2O4)(H2O)]2+(aq)
[Fe(C2O4)(H2O)]2+(aq)
→ [Fe(C2O4)]2+(s)
+ H2O(aq)
Rendemen yang didapatkan sebesar 97,85%.
2. Rumus molekul senyawa kompleks besi (II) oksalat yang didapatkan yaitu [Fe(C2O4)(H2O)2].
H. Daftar Pustaka
- Arsyad. 2001. Kamus Arti dan Penjelasan Intisari. Jakarta. Gramedia.
- Cahyono. 1991. Segi Praktisi dan Metode Pemisahan Senyawa Organik. Semarang: Universitas Diponegoro.
- Daintith, J. 2004. The Facts on File Dictionary of Inorganic Chemistry. New York: Market House Books.
- Day dan Underwood. 2002. Kimia Analisis Kualitatif. Jakarta: Erlangga.
- Harjadi, W. 1990. Ilmu Kimia Analitik Dasar. Jakarta: Gramedia.
- Pudyaatmaka, A. H. 2002. Kamus Kimia. Jakarta: Balai Pustaka.
- Rivai, H. 1994. Asas Pemeriksaan Kimia. Jakarta: UI Press.
- Saito, T. 1996. Buku Teks Online Kimia Anorganik. Tokyo: Shoten.
Posting Komentar untuk "Laporan Praktikum Sintesis dan Penentuan Rumus Molekul Senyawa Kompleks Besi (II) Oksalat"