Laporan Praktikum Sintesis Natrium Tiosulfat dengan Metode Kristalisasi
Glosaria.com - Percobaan berjudul Sintesis Natrium Tiosulfat dengan Metode Kristalisasi bertujuan membuat senyawa natrium tiosulfat, memahami proses kristalisasi natrium tiosulfat, memurnikan kristal natrium tiosulfat, dan enguji tingkat kemurnian natrium tiosulfat secara kualitatif. Prinsip kerja dari percobaan ini yaitu metode kristalisasi melalui proses refluks.
PRAKTIKUM KIMIA
ANORGANIK
“SINTESIS NATRIUM TIOSULFAT DENGAN METODE KRISTALISASI”
A. Tujuan
- Membuat senyawa natrium tiosulfat.
- Memahami proses kristalisasi natrium tiosulfat.
- Memurnikan kristal natrium tiosulfat.
- Menguji tingkat kemurnian natrium tiosulfat secara kualitatif.
B. Dasar Teori
1. Kristalisasi
Kristalisasi atau penghabluran adalah peristiwa pembentukan partikel-partikel zat padat di dalam suatu fase homogen, kristalisasi dapat terjadi sebagai pembentukan partikel padat di dalam uap dan sebagai pembekuan di dalam lelehan cair. Kristalisasi juga merupakan proses pemisahan solid-liquid, karena pada kristalisasi terjadi perpindahan massa solute dari larutan liquid ke padatan murni pada fase kristal (Pinalia, 2011).
Prinsip kristalisasi terbentuk melalui dua tahap yaitu, nukleasi atau pembentukan inti kristal dan pertumbuhan kristal. Inti kristal dapat terbentuk dari berbagai jenis partikel molekul, atom atau ion. Karena adanya gerakan dari partikel-partikel tersebut, beberapa partikel mungkin membentuk suatu gerombolan atau kluster, kluster yang cukup banyak membentuk embrio pada kondisi leat jenuh yang tinggi embrio tersebut membentuk inti kristal. Pertumbuhan kristal adalah suatu proses difusi yang dimodifikasi oleh pengaruh permukaan padat tempat terlarut mencapai permukaan kristal yang tumbuh dengan cara difusi melalui fase zat cair (Pinalia, 2011).
Secara umum, faktor-faktor yang mempengaruhi proses pertumbuhan kristal sebagai berikut:
a. Temperatur
Pertumbuhan kristal pada temperatur tinggi dikendalikan oleh difusi, sedangkan pada temperatur rendah dikontrol oleh surface integration.
b. Ukuran kristal
Umumnya kecepatan pertumbuhan pada kristal yang berukuran kecil lebih tinggi daripada kecepatan pertumbuhan pada kristal yang berukuran besar.
c. Kelarutan dan supersaturasi
Kelarutan adalah kuantitas maksimal padatan yang dapat terkandung dalam suatu larutan. Larutan yang tidak mampu melarutkan padatan lagi disebut sebagai larutan jenuh. Supersaturasi merupakan keadaan dimana larutan mengandung konsentrasi padatan terlarut yang lebih tinggi daripada konsentrasi kesetimbangan (jenuh). Kristalisasi dapat terjadi hanya jika kondisi supersaturasi dapat dicapai (Fachry dkk., 2008).
2. Natrium tiosulfat
Natrium tiosulfat merupakan logam yang mengandung ion S2O3- dimana satu atom S menggugus satu atom O. dalam larutan-larutan asam, ion tiosulfat akan terurai menjadi S dan ion sulfit. Natrium tiosulfat berupa hablur besar, tidak berwarna, atau serbuk hablur kasar. Mengkilap dalam udara lembab dan mekar dalam udara kering pada suhu lebih dari 33oC (Arsyad, 2001).
Natrium tiosulfat dapat dibuat dengan mereaksikan belerang dan natrium tiosulfit sehingga membentuk persamaan reaksi sebagai berikut:
8Na2SO3.7H2O(s) + S8(s) → 8Na2S2O3(aq) + 7H2O(l)
Natrium tiosulfat dapat bereaksi dengan asam klorida tidak terjadi perubahan yang segera dalam keadaan dingin. Cairan yang diasamkan segera menjadi keruh karena pemisahan belerang dan dalam larutan terdapat asam sulfit. Dengan memanaskan larutan, belerang dioksida dilepaskan yang dapat dikenali dari bau dan kerjanya terhadap kertas saring yang dibasahi larutan kalium dikromat yang telah diasamkan. Belerang tadi mula-mula membentuk larutan kolodial yang berangsur-angsur dikoagulasikan oleh asam bebas. Reaksi-reaksi sampingan juga terjadi yang menimbulkan asam-asam tionat.
S2O32- + 2H+ → S ↓ + SO2 ↑ + H2O
Reaksi natrium tiosulfat dengan larutan iod yaitu terbentuk larutan ion tetrationat yang tidak berwarna. Reaksi yang terjadi sebagai berikut:
I2 + 2S2O32- → 2I- + S4O62-
Reaksi natrium tiosulfit dengan larutan perak nitrat membentuk endapan putih perak tiosulfat.
S2O32- + 2Ag+ → Ag2S2O3 ↓
Mula-mula tidak terjadi endapan, karena terbentuk kompleks ditiosulfatargentat (I) yang larut:
2S2O32- + Ag+ → [Ag(S2O3)2]3-
Endapan ini tidak stabil, berubah menjadi gelap setelah didiamkan, kemudian terbentuk perak sulfida.
Ag2S2O3 ↓ + H2O → Ag2S ↓ + 2H+ + SO42-
Penguraian hidrofilik ini dapat dipercepat dengan cara pemanasan. Natrium tiosulfat yang dilelehkan akan menghasilkan lelehan warna kuning yang merupakan kristal natrium (Svehla, 1985).
C. Alat dan Bahan
Alat-alat yang digunakan pada percobaan ini adalah refluks, tutup karet, tutup karet berlubang, termometer, gelas beaker 50 mL, gelas beaker 250 mL, gelas ukur 100 mL, pipet ukur 10 mL, bola hisap, batang pengaduk kaca, batang magnetik kecil, gelas arloji, corong gelas, Bunsen spirtus, tabung reaksi, rak tabung reaksi, penjepit tabung reaksi, sendok sungu, baskom, pinset, korek api, spatula, botol akuades, kertas saring, hot plate, oven, neraca analitik, mikroskop, melting point apparatus, dan kaca preparate.
Bahan-bahan yang digunakan pada percobaan ini adalah Na2SO3.7H2O, serbuk belerang, HCl, AgNO3, I2, dan akuades.
D. Cara Kerja
Cara kerja yang pertama adalah pembuatan natrium tiosulfat. Sebanyak 15 gram Na2SO3.7H2O dan 2 gram serbuk belerang dicampurkan dalam labu alas bulat dan dilarutkan dalam 30 mL akuades. Kedua larutan dilarutkan dalam keadaan refluks selama 1 jam hingga sebagian besar serbuk belerang larut dan dicatat temperatur konstan reaksi. Setelah itu, larutan disaring dalam keadaan panas lalu filtratnya diuapkan sampai volume berkurang setengahnya. Kemudian kristal didinginkan dengan penangas es sampai aktivitas pembentukan kristal berhenti. Selanjutnya endapan kristal disaring dan dikeringkan di dalam oven. Setelah itu, kristal yang diperoleh ditimbang dan dihitung rendemennya.
Cara kerja yang kedua adalah uji sifat-sifat natrium tiosulfat. Pertama, uji bentuk kristal dengan cara kristal natrium tiosulfat diperiksa bentuknya dengan menggunakan mikroskop. Kedua, uji titik leleh dengan menggunakan alat melting point apparatus. Ketiga, uji higroskopis dilakukan dengan cara kristal dimasukkan ke dalam tabung reaksi lalu dipanaskan. Keempat, uji warna nyala kristal yang dihasilkan dengan menggunakan kawat nikrom dan diamati warna nyala. Kelima, uji sifat reaksi reduksi-oksidasi dilakukan dengan cara kristal dilarutkan dalam 10 mL akuades dan ditambahkan I2 secara berlebih. Keenam, uji ion klorida dilakukan dengan cara kristal dilarutkan dalam 10 mL akuades. Larutan tersebut diambil 3 mL dan ditambah 3 mL HCl. Terakhir, uji AgNO3 dilakukan dengan cara 3 mL larutan kristal ditambahkan 3 mL AgNO3. Campuran dikocok dan didiamkan beberapa saat. Selanjutnya campuran dipanaskan dalam tabung reaksi.
E. Hasil dan Pembahasan
Percobaan yang dilakukan berjudul Sintesis Natrium Tiosulfat dengan Metode Kristalisasi. Pembuatan natrium tiosulfat diawali dengan cara mereaksikan Na2SO3.7H2O dengan serbuk belerang yang dilarutkan dengan akuades menghasilkan endapan kuning dan tidak larut. Endapan kuning yang dihasilkan merupakan serbuk belerang yang tidak larut. Proses refluks dilakukan pada percobaan ini agar struktur molekul sulfur yang membentuk cincin mengandung 8 atom (S8) dapat diputuskan, sehingga dapat bereaksi dengan natrium sulfit. Terjadi kondensasi pada kondisi refluks yang disebabkan karena larutan menguap akibat pemanasan kemudian didinginkan, sehingga uap tersebut menjadi larutan kembali. Setelah direfluks selama 1 jam, larutan disaring dalam keadaan panas untuk mencegah terbentuknya kristal dalam kertas saring.
Setelah disaring, filtrat kemudian diuapkan sampai terbentuk kristal. Proses penguapan bertujuan untuk menghilangkan molekul air yang bukan pentahidrat dan untuk menghilangkan zat-zat pengotor yang terdapat dalam kristal. Kemudian kristal didinginkan menggunakan penangas es. Saat kristal didinginkan endapan kristal putih yang terbentuk semakin banyak, hal ini dikarenakan pembentukan kristal berlangsung pada suhu ekstrem yaitu dari suhu yang sangat tinggi ke suhu yang sangat rendah. Kemudian kristal disaring dan dikeringkan dalam oven lalu diperoleh massa natrium tiosulfat sebesar 2,6937 gram dengan rendemen 26,6386%. Persamaan reaksi yang terjadi sebagai berikut:
8Na2SO3.7H2O(s) + S8(s) → 8Na2S2O3(aq) + 7H2O(l)
Sedikitnya rendemen yang diperoleh karena kristal yang terbentuk sangat sedikit. Rendemen yang dihasilkan kecil dikarenakan pada saat refluks tidak semua belerang larut dan kemungkinan pemutusan cincin S8 belum sempurna.
Hasil uji sifat-sifat natrium tiosulfat bentuk kristal yang diperoleh seperti pada gambar.
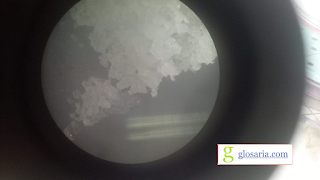 |
| Kristal Natrium Tiosulfat |
Kedua, uji titik leleh menggunakan melting point apparatus diperoleh titik leleh sebesar 48,1oC. Secara teori titik leleh natrium tiosulfat memiliki titik leleh 48oC dan diperoleh %kemurnian sebesar 99,58%. Uji ketiga yaitu uji higroskopis dengan cara kristal dimasukkan ke dalam tabung reaksi dan dipanaskan. Berdasarkan pengamatan kristal yang dipanaskan meleleh dan berubah warna menjadi kuning. Keempat, uji nyala menghasilkan warna kuning yang menunjukkan terdapat ion Na+ pada kristal.
Uji sifat-sifat natrium tiosulfat selanjutnya yaitu dengan cara menambahkan larutan I2 ke dalam kristal yang sudah dilarutkan dengan akuades. Persamaan reaksi redoks yang terjadi sebagai berikut:
Reduksi: I2 + 2e-
→ 2I-
oksidasi: 2S2O32- → S4O6- + 2e-
Hasil: 2Na2S2O3 + I2 → 2NaI + Na2S4O6
Berdasarkan reaksi tersebut terlihat bahwa natrium tiosulfat mereduksi iod. Saat ditambahkan akuades dan I2 berlebih, larutan yang semula berwarna cokelat kemudian melarut dan berubah menjadi tidak berwarna.
Uji sifat-sifat natrium tiosulfat selanjutnya yaitu uji HCl dengan cara menambahkan larutan HCl ke dalam kristal yang sudah dilarutkan dengan akuades. Persamaan reaksinya sebagai berikut:
Na2S2O3(aq) + 2HCl(aq) → 2NaCl(aq) + H2S2O3(aq)
Berdasarkan pengamatan dihasilkan larutan keruh karena pemisahan belerang dan terdapat asam sulfit. Persamaan reaksinya sebagai berikut:
S2O32- + 2H+ → S + SO2 + H2O
Uji sifat yang terakhir adalah uji perak nitrat dengan cara mereaksikan larutan natrium tiosulfat dengan larutan AgNO3. Berdasarkan pengamatan larutan muncul endapan warna coklat. Persamaan reaksi yang terjadi sebagai berikut:
Ag2S2O3 + H2O → Ag2S + 2H+ + SO42-
Endapan yang terbentuk berasal dari ion [Ag(S2O3)2]3-. Persamaan reaksi yang terjadi sebagai berikut:
2S2O32- + Ag+ → [Ag(S2O3)2]3-
F. Kesimpulan
Berdasarkan percobaan yang telah dilakukan disimpulkan bahwa:
- Natrium tiosulfat dapat dibuat dengan mereaksikan natrium tiosulfit heptahidrat dan belerang, lalu dilarutkan dalam keadaan refluks.
- Kristal natrium tiosulfat dapat diperoleh dengan cara diuapkan dan didinginkan.
- Pemurnian kristal natrium tiosulfat dilakukan dengan mengkristalkan kembali larutan yang didapat dari pencampuran Na2SO3.7H2O dan serbuk belerang.
- Uji kristal sifat-sifat natrium tiosulfat yaitu dilakukan dengan uji bentuk kristal, uji titik leleh, uji nyala, uji sifat higroskopis, uji sifat reduksi-oksidasi, uji ion klorida, dan uji perak nitrat.
- Tingkat kemurnian natrium tiosulfat yaitu 99,58% dan rendemen 26,63%.
G. Daftar Pustaka
- Arsyad. 2001. Kamus Kimia. Jakarta: PT. Gramedia Pustaka Utama.
- Fachry, A. R., Tumanggur, J. dan Yuni, N. P. E. 2008. Pengaruh Waktu Kristalisasi dengan Proses Pendinginan Terhadap Pertumbuhan Kristal Amonium Sulfat dari Larutannya. Jurnal Teknik Kimia Vol. 15 No. 2.
- Pinalia, A. 2011. Kristalisasi Amonium Perkolat (AP) dengan Sistem Pendinginan Terkontrol Untuk Menghasilkan Kristal Berbentuk Bulat. Jurnal Teknologi Dirgantara Vol. 9 No.2.
- Sugiyarto, K. 2004. Kimia Anorganik I. Yogyakarta: Graha Ilmu.
- Svehla, G. 1985. Vogel Buku Teks Analisis Anorganik Kualitatif Makro dan Semimikro. Jakarta: PT. Kalman Media Pustaka.
Posting Komentar untuk "Laporan Praktikum Sintesis Natrium Tiosulfat dengan Metode Kristalisasi"