Laporan Praktikum Sintesis Aspirin (Asam Asetil Salisilat) Dengan Metode Rekristalisasi
Praktikum kimia organik sintesis aspirin dari asam salisilat dan asam asetat anhidrida. Percobaan pembuatan aspirin ini bertujuan untuk mempelajari reaksi anhidrida dengan metode rekristalisasi. Reaksi kimia pada proses sintesis aspirin adalah reaksi esterifikasi.
"SINTESIS ASPIRIN"
A. Tujuan
Mempelajari reaksi anhidrida asam karboksilat dengan gugus hidroksi fenolik dari asam salisilat.
B. Dasar Teori
1. Asam salisilat
Asam salisilat (C7H6O3) berbentuk kristal kecil yang memiliki berat molekul sebesar 138,123 g/mol dengan titik leleh sebesar 156 oC. Asam salisilat mudah larut dalam keadaan dingin tetapi dapat melarutkan dalam keadaan panas. Apabila dipanaskan pada suhu 200 oC asam salisilat dengan mudah terdekomposisi menjadi karbon dioksida dan fenol. Asam salisilat kebanyakan digunakan sebagai bahan obat-obatan dan intermediet pada pabrik obat-obatan dan pabrik farmasi seperti aspirin dan beberapa turunannya (Kristian, 2007).
2. Aspirin
Asam asetil salisilat atau biasa disebut dengan aspirin memiliki peranan sangat besar dalam bidang farmasi. Senyawa aspirin dapat diperoleh dengan cara sintesis karena aspirin tidak terdapat dalam keadaan bebas di alam. Aspirin atau asam asetil salisilat adalah turunan dari senyawa asam salisilat. Pembuatan aspirin dengan cara asetilasi anhidrida fenol (dalam bentuk asam salisilat) menggunakan anhidrida asetat dengan bantuan sedikit asam sulfat pekat sebagai katalisator (Baysinger, 2004).
Asam salisilat (o-hydrexiy benzoic acid) pada pembuatan aspirin berfungsi sebagai alkohol dan reaksinya berlangsung pada gugus hidroksi. Aspirin bersifat analgesik yang digunakan sebagai penawar nyeri. Aspirin digunakan untuk mengurangi sakit pada cedera ringan karena sifatnya sebagai anti-inflamasi. Selain itu, aspirin sebagai zat antipretik berfungsi sebagai obat penurun demam (Baysinger, 2004).
3. Reaksi Esterifikasi
Ester merupakan turunan asam karboksilat yang gugus -OR dari alkohol. Ester dapat dibuat dari asam dengan alkohol atau dari anhidra asam dengan alkohol. Suatu asam ester karboksilat ialah suatu senyawa yang mengandung gugus -CO2R dengan R dapat terbentuk alkil maupun asil. Alkohol dengan asam karboksilat dan turunan asam karboksilat dan turunan asam karboksilat. Reaksi ini disebut dengan reaksi esterifikasi (Fessenden dan Fessenden, 1986).
4. Rekristalisasi
Rekristalisasi adalah metode pemurnian suatu kristal dari pengotor-pengotornya. Campuran senyawa akan dimurnikan dengan dilarutkan dalam pelarut yang bersesuai dengan temperatur yang dekat dengan titik didihnya. Pengotor atau zat lain dapat dipisahkan dari zat yang diinginkan dengan melakukan penyaringan hingga terbentuk kristal (Cahyono, 1991).
 |
| Sintesis Aspirin Metode Rekristalisasi |
C. Alat dan Bahan
Alat-alat yang digunakan pada percobaan ini adalah gelas beaker 150 mL, gelas beaker 250 mL, gelas beaker 500 mL, gelas ukur 100 mL, labu alas datar, gelas arloji, sendok sungu, pengaduk kaca, termometer, corong gelas kecil, pinset, kertas saring, magnetic stirrer, penangas air, toples, bumsen spiritus, korek api, statif dan klem, tutup karet, corong Buchner, pipet tetes, hot plate, dan botol akuades.
D. Cara Kerja
Asam salisilat sebanyak 5 gram dan 7,5 gram asam asetat anhidrida ke dalam labu alas datar serta ditambahkan 5 tetes asam sulfat pekat. Campuran dikosok sampai terjadi campuran sempurna kemudian dipanaskan dengan penangas air pada suhu 50-60 oC sambil diaduk selama 15 menit. Didinginkan sambil tetap diaduk dan ditambahkan 75 mL akuades. Kemudian disaring dengan penyaring Buchner. Residu yang diperoleh dimurnikan dengan menggunakan pelarut akuades panas 100 mL. Kemudian disaring kembali menggunakan corong gelas. Hasil penyaringan dimasukkan ke dalam gelas beaker yang disekelilingnya telah diberi es batu. Kemudian direkristalisasi sampai terbentuk kristal lalu disaring kembali menggunakan penyaring Buchner dan kertas saring yang digunkan telah ditimbang massanya. Setelah itu, kristal/residu dipanaskan menggunakan oven selama kurang lebih 10 menit. Kristal yang dihasilkan ditimbang dan dihitung hasil rendemennya. Kemudian dilakukan uji titik leleh aspirin yang telah dihasilkan dengan menggunakan melting point apparatus.
E. Data Hasil Pengamatan
|
No. |
Cara Kerja |
Pengamatan |
|
1. |
5 gram asam salisilat dan 7,5 gram asetat anhidrida dimasukkan ke dalam labu alas datar |
Massa asam salisilat = 5,0073 gram Massa asam asetat anhidrida = 7,5050 gram Warna larutan menjadi putih keruh dengan sedikit endapan |
|
2. |
Ditambahkan 5 tetes asam sulfat pekat |
Warna larutan menjadi tidak berwarna dan larutan menjadi hangat |
|
3. |
Campuran dikocok sampai terjadi campuran sempurna |
Larutan tidak larut sempurna |
|
4. |
Dipanaskan pada suhu 50-60 oC sambil |
Warna larutan menjadi putih keruh dan muncul endapan |
|
5. |
Didinginkan sambil tetap diaduk dan ditambahkan 75 mL akuades |
Endapan tidak larut sempurna |
|
6. |
Disaring dengan menggunakan penyaring Buchner |
Endapan terdapat di kertas saring |
|
7. |
Dimurnikan dengan menggunakan pelarut akuades panas |
Larutan dan endapan berwarna putih |
|
8. |
Larutan direkristalisasi dengan menggunakan es batu |
Terbentuk padatan kristal putih |
|
9. |
Disaring dengan menggunakan penyaring Buchner |
Terbentuk endapan di kertas saring Massa kertas saring = 0,3960 gram |
|
10. |
Dipanaskan menggunakan oven selama 20 menit |
Endapan menjadi kering |
|
11. |
Ditimbang massa hasil rekristalisasi dan massa kristal dihitung |
Massa hasil rekristalisasi = 0,7443 gram Massa kristal = massa hasil
rekristalisasi - massa kertas saring = 0,3483 gram |
|
12. |
Diuji titik leleh kristal dengan menggunakan melting point apparatus |
Titik leleh = 135,4 oC % Titik leleh = 0,2963% |
|
13. |
Dihitung rendemen dan kemurnian yang telah dihasilkan dari percobaan |
Rendemen = 5,3379% Kemurnian = 99,7037% |
F. Pembahasan
Percobaan yang dilakukan berjudul Sintesis Aspirin. Tujuan dari percobaan ini adalah mempelajari reaksi anhidrida asam karboksilat dengan gugus hidroksi fenolik dari asam salisilat. Prinsip kerja pada percobaan ini adalah metode rekristalisasi yang sebelumnya terjadi reaksi esterifikasi.
Aspirin merupakan senyawa turunan asam salisilat yang dapat disintesis melalui reaksi esterifikasi. Asam salisilat pada anhidrida asam asetat sehingga terjadi substitusi gugus hidroksi (-OH) pada asam salisilat dengan gugus asetil pada anhidrat asetat.
Percobaan sintesis aspirin direaksikan asam salisilat dan asam asetat anhidrida. Pencampuran keduanya tidak saling larut sehingga warna larutan menjadi putih keruh dan terbentuk sedikit endapan. Asam asetat anhidrida digunakan karena tidak mengandung air dan mudah menyerap air. Tujuan penggunaan asam asetat anhidrida untuk mencegah adanya air karena jika terdapat air maka kristal dari aspirin akan terurai kembali menjadi asam salisilat dan asam asetat anhidrida. Setelah mereaksikan asam salisilat dan asam asetat anhidrida, larutan tersebut ditambahkan beberapa tetes asam sulfat pekat. Penambahan asam sulfat pekat berfungsi sebagai katalisator untuk mempercepat terjadinya sintesa dengan cara menurunkan energi aktivasi sehingga energi yang diperlukan dalam sintesa sedikit dan suhu menjadi naik.
Langkah kerja selanjutnya yaitu pemanasan pada suhu 50-60 oC selama 15 menit. Pemanasan bertujuan untuk menghilangkan zat-zat pengotor yang terdapat pada larutan sehingga menghasilkan aspirin dengan tingkat kemurnian yang tinggi. Pemanasan ini juga bertujuan untuk mempercepat kelarutan asam salisilat. Setelah dilakukan pemanasan larutan menjadi putih keruh dan muncul sedikit endapan, larutan didinginkan dan ditambahkan akuades. Kemudian disaring menggunakan kertas saring dan penyaring Buchner untuk mempercepat penyaringan. Hasil residu penyaringan dimurnikan untuk melarutkan pelarut akuades panas yang bertujuan untuk melarutkan asam salisilat sebagai bahan baku pembentukan aspirin. Kemudian larutan larutan direkristalisasi dengan cara disaring dan hasil penyaringan tetes demi tetes masuk ke dalam gelas beaker yang disekelilingnya telah diberi es batu. Pemberian es batu bertujuan untuk mempercepat pembentukan kristal. Proses pendinginan dapat membentuk kristal karena pada suhu rendah (dingin) molekul-molekul aspirin dalam larutan akan bergerak melambat dan pada akhirnya terkumpul membentuk endapan melalui proses nukleasi.
Kristal yang diperoleh kemudian disaring kembali menggunakan penyaring Buchner. Hal ini bertujuan untuk memisahkan kristal dan air. Kemudian kristal dipanaskan menggunakan oven selama kurang lebih 10 menit untuk memisahkan antara padatan kristal dan air. Hasil penimbangan menunjukkan massa kristal aspirin sebesar 0,3483 gram dengan persentase rendemen sebesar 5,3379%. Kristal yang dihasilkan diuji titik lelehnya sebesar 135,4% dan % titik lelehnya sebesar 0,2963%. Persentase kemurnian aspirin diperoleh sebesar 99,7037%.
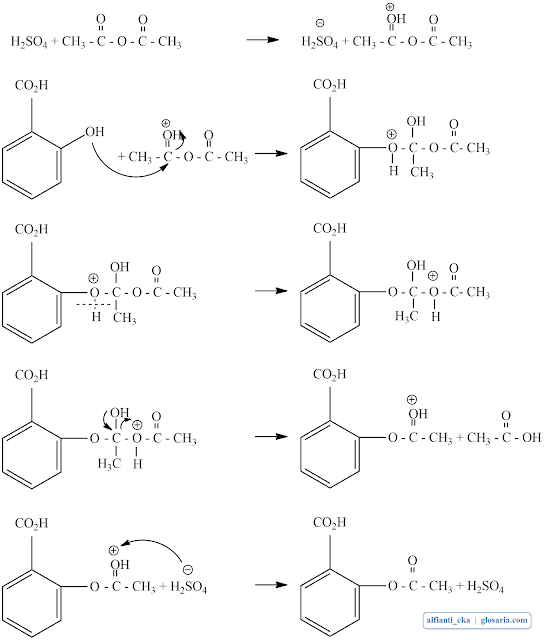
Berdasarkan percobaan yang dilakukan diperoleh mekanisme reaksi yang terjadi sebagai berikut:
Mekanisme yang terjadi adalah asam asetat anhidrida menyerang H+ dan mengalami resonansi. Anhidrida asam asetat menyerang gugus fenol dari asam salisilat H+ terlepas dari OH- dan berikatan dengan atom O pada asam asetat anhidrida. Asam asetat anhidrida terputus menjadi asam asetat dan asam asetil salisilat (aspirin) H+ akan terlepas dari aspirin. Reaksi total yang terjadi sebagai berikut:
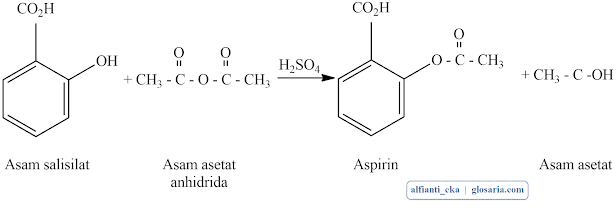 |
| Mekanisme reaksi sintesis aspirin |
G. Kesimpulan
Berdasarkan percobaan Sintesis Aspirin dapat disimpulkan bahwa reaksi anhidrida asam karboksilat dengan gugus hidroksi fenolik dari asam salisilat disebut dengan reaksi asetilasi atau reaksi esterifikasi yaitu reaksi antara alkohol dan asam sehingga dihasilkan suatu ester dan air. Reaksi yang terjadi pada percobaan sintesis aspirin adalah sebagai berikut:
 |
| Mekanisme reaksi sintesis aspirin |
Persentase hasil (rendemen) yang diperoleh dari percobaan sintesis aspirin sebesar 5,3379% dan kemurniannya sebesar 99,7037%.
H. Daftar Pustaka
- Baysinger, G. 2004. CRC Handbook of Chemistry and Physics 85th ed. America: CRC Press.
- Cahyono. 1991. Segi Praktisi dan Metode Pemisahan Senyawa Organik. Semarang: FMIPA Universitas Diponegoro.
- Fessenden, R. J., dan Fessenden, J. S. 1986. Kimia Organik Jilid 2. Jakarta: Erlangga.
- Kristian, R. 2007. Asam Salisilat dan Phenol. Banten: Teknik Kimia Universitas Ageng Tirtayasa.
Lampiran
Perhitungan Sintesis Aspirin
- Diketahui:
massa asam salisilat = 5,0073 gram
Mr asam salisilat = 138,12 gram/mol
massa asam asetat anhidrida = 7,5030 gram
Mr asam asetat anhidrida = 102,09 gram/mol
massa aspirin percobaan = 0,3483 gram
Mr aspirin = 180 gram/mol
titik leleh aspirin percobaan = 135,4 oC
- Mol asam salisilat
= Massa : Mr
= 5,0073 gram : 138,12 g/mol
= 0,03625 mol
- Mol asam asetat anhidrida
= Massa : Mr
= 7,5030 gram : 102,09 g/mol
= 0,0735 mol
|
|
asam salisilat |
+ |
asam asetat anhidrida |
-> |
aspirin |
+ |
asam asetat |
|
M |
0,03625 |
|
0,0735 |
|
- |
|
- |
|
R |
0,03625 |
|
0,03625 |
|
0,03625 |
|
0,03625 |
|
S |
- |
|
0,03725 |
|
0,03625 |
|
0,03625 |
- Massa aspirin
= mol x Mr
= 0,03625 mol x 180 g/mol
= 6,525 gram
- Rendemen
= (massa percobaan : massa teori) x 100%
= (0,3483 gram : 6,525 gram) x 100%
= 5,3379%
- %titik leleh
= | (135,4 - 135) :135) x 100%
= 0,2963%
- Kemurnian
= 100% - %titik leleh
= 100% - 0,2963%
= 99,70737

Posting Komentar untuk "Laporan Praktikum Sintesis Aspirin (Asam Asetil Salisilat) Dengan Metode Rekristalisasi"