Laporan Praktikum Sintesis Etil Asetat Melalui Reaksi Esterifikasi
Praktikum sintesis etil asetat bertujuan untuk mensintesis etil asetat dari etanol dan asam asetat melalui esterifikasi pada skala mikro. Etil asetat didapatkan melalui pencampuran asam asetat pada etanol dengan katalis asam sulfat pekat. Raksi tersebut disebut dengan reaksi esterifikasi fischer. Metode yang digunakan pada praktikum ini adalah refluks, destilasi dan dilanjutkan dengan ekstraksi cair-cair. Berikut laporan praktikum mekanisme reaksi organik sintesis etil asetat.
"SINTESIS ETIL ASETAT"
A. Tujuan
- Mensintesis etil asetat dari etanol dan asam asetat melalui esterifikasi pada skala mikro.
B. Dasar Teori
1. Etil Asetat
Etil asetat adalah senyawa organik dengan rumus CH3COOC2H5. Senyawa ini tidak berwarna dan memiliki aroma yang khas. Etil asetat adalah pelarut polar yang bersifat volatil, tidak beracun, dan higroskopis. Etil asetat dibuat dengan asam dan etanol dengan reaksi esterifikasi fischer. Reaksi antara asam asetat dan etanol akan menghasilkan etil asetat dengan persamaan reaksi sebagai berikut:
Etil asetat memiliki berat molekul 88,11 g/mol, densitas 0,897 g/mL, kelarutan 0,902 g/cm3 dan titik didih 77,1oC. Etil asetat sering digunakan dalam dunia industri diantaranya sebagain bahan pelarut cat, bahan baku pembuatan plastik untuk kebutuhan industri farmasi, sebagai bahan baku bagi industri tinta cetak, bahan baku parfum, flavour, kosmetik, dan minyak atsiri (Mc. Kelta, 1994).
2. Esterifikasi
Asam karboksilat apabila direaksikan dengan alkohol dan bantuan katalisator asam akan menghasilkan ester. Reaksi tersebut biasa disebut dengan esterifikasi fischer. Reaksi keseluruhan merupakan pergantian gugus fungsi -OH dari asam karboksilat dengan gugus -OR dari alkohol.
Dalam larutan asam, oksigen karbonil dari suatu ester dapat diprotonasikan kemudian karbonil yang bermuatan positif parsial dapat diserang oleh nukleofil lemah seperti air.
Dalam larutan basa, karbon karbonil suatu ester dapat diserang oleh suatu nukleofil yang baik tanpa protonasi sebelumnya. Jalan adisi-eliminasi ini sama dengan klorida asam dan anhidrida:
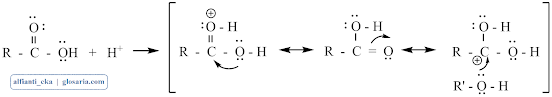
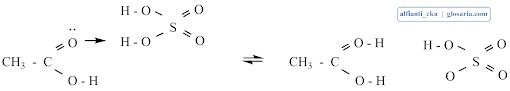
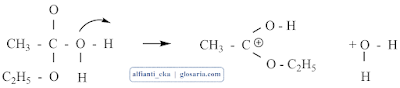
Mekanisme reaksi esterifikasi merupakan reaksi substitusi nukleofilik dengan katalisator asam. Gugus karbonil dari asam karboksilat tidak cukup kuat sebagai elektrofil untuk diserang oleh alkohol. Katalis asam akan memprotonasi gugus karbonil dan mengaktivasinya ke arah penyerangan nukleofil. Pelepasan proton akan menghasilkan hidrat dari ester kemudian terjadi transfer elektron:
Pelepasan air akan membentuk ester terprotonasi dan pelapisan proton akan menghasilkan ester.3. Destilasi
Destilasi merupakan teknik pemisahan yang didasari atas perbedaan titik didih atau titik cair dari masing-masing zat penyusun dari campuran homogen. Dalam proses destilasi terdapat dua tahap proses yaitu tahap penguapan dan dilanjutkan dengan tahap pengembangan kembali uap menjadi cair dan padatan. Atas dasar inilah maka perangkat peralatan destilasi menggunakan alat pemanas dan alat pendingin. Proses destilasi diawali dengan pemanasan, sehingga zat yang memiliki titik didih lebih rendah akan menguap. Uap tersebut bergerak menuju kondensor yaitu pendingin. Proses pendinginan terjadi karena air mengalir ke dalam dinding (bagian luar kondensor) sehingga uap yang dihasilkan akan kembali cair. Proses ini berjalan terus-menerus dan akhirnya senyawa-senyawa yang ada dalam campuran homogen dapat dipisahkan (Sugihara, 1961).
4. Refluks
Refluks adalah metode yang melibatkan kondensasi uap suatu zat yang dipanaskan sehingga zat yang menguap kembali ke sistem dari mana dia berasal. Prinsip kerja pada refluks yaitu penarikan komponen kimia yang dilakukan dengan cara memasukkan sampel ke dalam labu alas bulat bersama-sama kemudian dipanaskan. Uap-uap cairan terkondensasi pada kondensor bola menjadi molekul-molekul cairan yang turun kembali pada labu alas bulat (Akhyar, 2010).
 |
| Sintesis Etil Asetat Melalui Reaksi Esterifikasi |
5. Ekstraksi Cair-cair
Ekstraksi cair-cair adalah proses pemisahan solut dari cairan pembawa (diluen) menggunakan solven cair. Campuran diluen dan solven bersifat heterogen (tidak saling bercampur) dan jika dipisahkan terdapat dua fase yaitu fase rafinat berisi diluen dari sisa solut sedangkan fase ekstrak berisi solut dan solven (Mirwan, 2013).
Ekstraksi cair-cair digunakan untuk memisahkan senyawa atas dasar perbedaan kelarutan pada dua jenis pelarut yang berbeda dan tidak saling bercampur. Jika analit berada dalam pelarut anorganik, maka pelarut yang digunakan adalah pelarut organik dan sebaliknya (Khamidinal, 2009).
C. Alat dan Bahan
Alat yang digunakan dalam percobaan ini satu set alat refluks, set alat destilasi, tutup karet berlubang, tutup karet, termometer, statif dan klem, klem o ring, corong pisah 125 mL, erlenmeyer 125 mL, gelas beaker 100 mL, gelas ukur 10 mL, gelas ukur 25 mL, pipet ukur 10 mL, pipet ukur 25 mL, bola hisap, pengaduk, sendok sungu, corong gelas kecil, penangas+minyak, magnetic stirrer, kertas saring, kertas lakmus, alumunium foil, baskom, dan botol akuades.
Bahan yang digunakan dalam percobaan ini adalah etanol p.a., asam asetat glasial, asam sulfat pekat, CaCl2 anhidrous, natrium karbonat 30%, dan akuades.
D. Cara Kerja
Pada praktikum ini yang dilakukan terlebih dahulu adalah etanol sebanyak 15 mL, 20 mL asam asetat, dan 15 mL asam sulfat disiapkan dan dimasukkan ke dalam labu alas bulat. Campuran yang terbentuk kemudian di refluks selama 30 menit pada suhu 70oC, sambil diaduk menggunakan magnetic stirrer. Hasil dari refluks kemudian didiamkan dan didinginkan hingga mencapai suhu kamar. Kemudian campuran (hasil refluks) yang telah mencapai suhu kamar didistilasi dengan hasil destilat yang ditampung. Destilat kemudian dipindahkan ke dalam corong pisah dan ditambahkan natrium karbonat 30% tetes demi tetes hingga larutan menjadi netral dengan cara dicek menggunakan kertas lakmus. Larutan yang terbentuk dua lapisan kemudian dipisahkan dengan cara diambil larutan organik bagian atas sedangkan yang bagian bawah dibuang. Larutan organik yang didapat kemudian dicuci (dikocok) dan dikeringkan dengan CaCl2 anhidrous. Kemudian disaring dan diukur massa jenisnya.
E. Data Hasil Pengamatan
|
No. |
Cara Kerja |
Pengamatan |
|
1. |
15 mL etanol + 20 mL asam asetat glasial + 5 mL asam sulfat |
Larutan tidak berwarna |
|
2. |
Campuran direfluks selama 30 menit pada suhu 70oC |
Larutan menjadi keruh |
|
3. |
Larutan didistilasi dengan suhu maksimal 80oC |
Residu= larutan keruh kecoklatan Destilat= larutan tak berwarna |
|
4. |
Ditambahkan natrium karbonat 30% |
Lapisan atas= larutan organik Lapisan bawah= air |
|
5. |
Larutan organik dipisahkan |
Larutan tidak berwarna dan baunya khas |
|
6. |
Larutan organik dicuci dan dikeringkan dengan CaCl2 anhidrous |
Terdapat endapan putih CaCl2 |
|
7. |
Larutan disaring |
Massa= 16,9054gram Volume= 19 mL Rendemen = 74,6704% Massa jenis= 0,8897 g/mL |
F. Pembahasan
Percobaan ini berjudul Sintesis Etil Asetat. Tujuan dari percobaan ini yaitu untuk mensintesis etil asetat dari etanol dan asam asetat melalui esterifikasi pada skala mikro. Percobaan ini dilakukan dengan cara etanol, asam asetat glasial, dan asam sulfat pekat dicampurkan kemudian direfluks, didistilasi dan dipisahkan sehingga didapatkan etil asetat yang murni. Etil asetat didapatkan melalui pencampuran asam asetat pada etanol dan dengan katalis asam sulfat pekat. Raksi tersebut disebut dengan reaksi esterifikasi fischer.
Langkah pertama percobaan ini yaitu dicampurkan larutan etanol, asam asetat glasial, dan asam sulfat pekat kemudian direfluks selama 30 menit dengan suhu maksimal 70oC. Asam sulfat pekat berfungsi sebagai katalis yang digunakan untuk mempercepat reaksi. Campuran larutan direfluks sambil diaduk dengan tujuan agar larutan menjadi homogen dan untuk memutus gugus -OH untuk menyerang karbon karbonil. Refluks digunakan karena senyawa-senyawa yang dicampurkan bersifat mudah menguap. Uap hasil pemanasan akan terkondensasi kembali pada kondensor dan kembali lagi pada larutan awal sehingga didapatkan hasil yang maksimal. Reaksi yang terjadi sebagai berikut:
CH3COOH(aq) + C2H5OH(aq) <-> CH3COOC2H5 + H2O
Pada saat refluks, senyawa etil asetat sudah terbentuk. Pemanasan pada suhu maksimal 70oC bertujuan untuk menghindari etil asetat menguap karena titik didih etil asetat yaitu 83,6oC. mekanisme reaksi pembentukan etil asetat sebagai berikut:
Terjadi transfer proton dari asam sulfat yang kemudian berikatan dengan O2 dan menjadi bermuatan positif, kemudian terjadi delokasi elektron yang membentuk struktur resonansi:
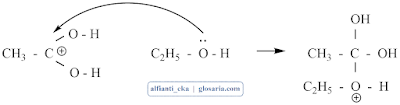
Kemudian karbon yang bermuatan positif diserang oleh PEB dari etanol:
Terjadi transfer proton dari oksigen ke oksigen lain.
Kemudian molekul air lepas.
Kemudian hidrogen akan lepas dari oksigen dan bereaksi dengan ion hidrogen sulfat dan berbentuk etil asetat serta katalis asam sulfat.
Setelah proses refluks selesai, larutan didinginkan hingga suhu kamar. Reaksi yang terjadi adalah reaksi reversible (reaksi bolak-balik) dan berjalan lambat sehingga dilakukan destilasi supaya didapatkan etil asetat yang murni. Prinsip kerja destilasi adalah perbedaan titik didih larutan. Pada percobaan ini, etil asetat akan menguap terlebih dahulu, terkondensasi pada kondensor dan akan didapatkan etil asetat murni. Pada akhir destilasi, didapatkan residu yang larutannya keruh kecokelatan dan destilat yang tidak berwarna.
Selanjutnya, larutan yang didapat lalu ditambahkan natrium karbonat 30%. Natrium karbonat berfungsi untuk menetralkan larutan. Larutan hasil destilasi mungkin masih mengandung asam sulfat dibuktikan dengan kertas lakmus biru yang berubah menjadi merah. Natrium karbonat ditambahkan hingga kertas lakmus tidak berubah warna menjadi merah yang menandakan larutan netral. Kemudian larutan diekstraksi menggunakan corong pisah. Dihasilkan gas dan terbentuk dua lapisan yaitu lapisan bawah keruh dan lapisan atas tidak berwarna. Reaksi yang terjadi sebagai berikut:
Na2CO3(aq) + H2SO4(aq) -> NaSO4(aq) + H2O(l) + CO2(g)
Lapisan yang berada di atas diambil kemudian dicuci dengan CaCl2 anhidrous. CaCl2 berfungsi untuk mengikat ion karbonat yang masih tertinggal dalam larutan. Terbentuk endapan putih yang merupakan senyawa CaCO3. Reaksi yang terjadi sebagai berikut:
Na2CO3(aq) + CaCl2(s) -> CaCO3(s) + 2NaCl(l)
Berdasarkan hasil percobaan, didapatkan volume etil asetat sebanyak 19 mL dengan massa sebesar 16,9054 gram dan rendemen yang dihasilkan yaitu 74,6704%. Didapatkan jumlah yang sedikit karena etil asetat bersifat mudah menguap pada saat percobaan. Kemudian didapatkan massa jenis etil asetat sebesar 0,8897 g/mL. Jika dibandingkan dengan massa jenis teori yaitu sebesar 0,902 g/mL, maka memiliki selisih sebesar 1,23%. Selisih tersebut menandakan bahwa masih terdapat banyak pengotor.
G. Kesimpulan
Berdasarkan percobaan yang telah dilakukan dapat disimpulkan bahwa etil asetat disintesis dari etanol dan asam asetat melalui esterifikasi dengan reaksi:
CH3COOH(aq) + C2H5OH(aq) -> CH3COOC2H5 + H2O
Menghasilkan etil asetat 16,9054 gram dengan rendemen 74,6704%. Volume etil asetat 19 mL dan massa jenisnya 0,8897 g/mL.
H. Daftar Pustaka
- Akhyar. 2010. Uji Daya Hambat dan Analisis KLT Bioautografi Ekstrak Akar dan Buah Bakau (Rhizophora stylosa Griff.) Terhadap Vibrio harveyi. Skripsi. Universitas Hasanuddin Makassar.
- Fessenden, R. J. dan Fessenden, J.J. 1989. Kimia Organik Jilid I. Jakarta: Erlangga.
- Khamidinal. 2009. Teknik Laboratorium Kimia. Yogyakarta: Pustaka Pelajar.
- Mc Ketta, John J. 1994. Encyclopedia of Chemical Processing and Design. USA: M. Pekter.
- Mirwan, A. 2013. Keberlakuan Model HB-GFT Sistem n-heksana-Mek-Air Pada Ekstraksi Cair-cair Kolom Isian. Konversi. Vol. 2 No. 1 32-38.
- Sugihara. 1961. Destilasi Sederhana. Jakarta: Erlangga.
- Sastrohamidjojo, H. 2001. Kimia Organik Dasar. Yogyakarta: UGM Press.
Lampiran
Perhitungan Sintesis Kloroform
- Massa asam asetat
= Massa jenis x volume
= 1,05 g/mL x 20 mL
= 21 gram
- Mol asam asetat
= Massa : Mr
= 21 gram : 60,05 g/mol
= 0,349 mol
-Massa etanol
= Massa jenis x volume
= 0,7893 g/mL x 15 mL
= 11,7045 gram
- Mol etanol
= Massa : Mr
= 11,7045 gram : 46,07 g/mol
= 0,257 mol
|
|
CH3COOH |
+ |
C2H5OH |
-> |
CH3COOC2H5 |
+ |
H2O |
|
M |
0,349 |
|
0,257 |
|
- |
|
|
|
R |
0,257 |
|
0,257 |
|
0,257 |
|
|
|
S |
0,092 |
|
- |
|
0,257 |
|
|
- Massa etil asetat
= mol x Mr
= 0,257 mol x 88,11 g/mol
= 22,64 gram
- Volume teori
= massa : massa jenis
= 22,64 gram x 0,897 g/mL
= 24,52 mL
-Rendemen
= (massa percobaan : massa teori) x 100%
= (16,9054 gram : 22,64 gram) x 100%
= 74,6704%
- Massa jenis
= massa : volume
= 16,9054 gram : 19 mL
= 0,8897 g/mL


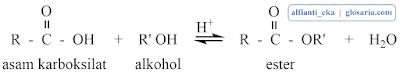
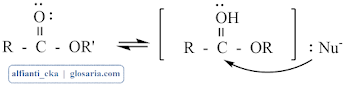
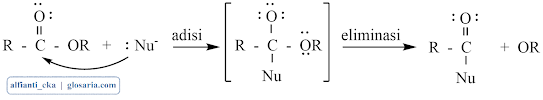
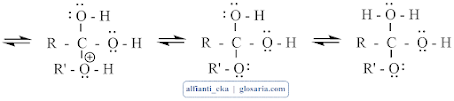

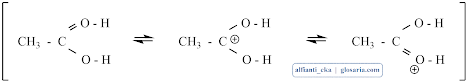


Posting Komentar untuk "Laporan Praktikum Sintesis Etil Asetat Melalui Reaksi Esterifikasi"