Laporan Praktikum Sifat Koligatif Larutan dan Pengenceran
Glosaria.com - Praktikum yang berjudul sifat fisik larutan: pengenceran dan sifat koligatif ini bertujuan untuk melakukan perhitungan untuk mengkonversi suatu konsentrasi ke konsentrasi lainnya dan memahami hubungan antara konsentrasi dan sifat koligatif. Prinsip kerja dari praktikum ini yaitu pengenceran larutan dan kenaikan titik didih larutan garam (NaCl) dan larutan sukrosa (C12H22O11).
Laporan praktikum sifat koligatif larutan ini merupakan seri laporan praktikum sifat koligatif larutan kenaikan titik didih. Berikut laporan praktikum selengkapnya yang dapat kamu jadikan sebagai referensi belajar.
“SIFAT FISIK LARUTAN: PENGENCERAN DAN SIFAT KOLIGATIF”
A. Tujuan
- Mampu melakukan perhitungan untuk mengkonversi suatu konsentrasi ke konsentrasi lainnya.
- Memahami hubungan antara konsentrasi dan sifat koligatif kenaikan titik didih pada larutan elektrolit maupun non elektrolit.
B. Dasar Teori
1. Larutan
Larutan merupakan campuran yang homogen dari dua atau lebih zat. Suatu larutan terdiri dua komponen penyusun larutan, yaitu zat terlarut dan pelarut. Zat yang jumlahnya lebih sedikit disebut zat terlarut, sedangkan zat yang jumlahnya lebih banyak disebut pelarut. Larutan dapat berwujud gas, padat, maupun cairan (Chang, 2004).
BACA: Mengenal Jenis dan Komponen Larutan Kimia
Semua zat terlarut dalam air termasuk ke dalam salah satu dari dua golongan zat, yaitu elektrolit dan non elektrolit. Elektrolit merupakan zat yang ketika dilarutkan dalam air akan menghasilkan larutan yang dapat menghantarkan arus listrik. Non elektrolit tidak menghasilkan arus listrik ketika dilarutkan dalam air. Asam dan basa merupakan elektrolit. Beberapa asam seperti asam klorida dan asam nitrat termasuk elektrolit kuat. Sedangkan elektrolit lemah yaitu asam asetat, HF, dan NH3 (Baroroh, 2004).
Larutan air dari senyawa ion maupun senyawa kovalen merupakan penghantar listrik yang sangat baik. Zat-zat yang berada dalam larutan berbentuk ion disebut elektrolit kuat. Elektrolit terdiri dari 3 tipe yaitu asam, basa, dan garam. Untuk asam dan basa terdapat elektrolit kuat dan elektrolit lemah. Untuk garam merupakan elektrolit kuat karena senyawa ionik (Keenan, 1992).
2. Konsentrasi Larutan
Sifat-sifat fisik dari suatu larutan ditentukan oleh perbandingan relatif atau konsentrasi dari berbagai komponen larutannya. Telah ditemukan bahwa beberapa satuan konsentrasi dapat digunakan untuk sifat fisik dari larutan. Satuan dalam konsentrasi merupakan suatu pembanding dapat dilihat dari pembanding dan penyebutnya (Brady, 1992).
Konsentrasi larutan merupakan banyaknya zat terlarut yang terdapat dalam sejumlah tertentu larutan. Beberapa macam konsentrasi yang sering digunakan antara lain:
a. Fraksi Mol dan Persen Mol
Fraksi mol merupakan perbandingan banyaknya mol suatu zat dengan jumlah mol seluruh zat yang terdapat dalam campuran tersebut. Apabila fraksi mol diberi tanda X, maka fraksi mol zat A dalam larutan dinyatakan XA. Dengan nA, nB dan seterusnya merupakan banyaknya mol komponen. Jumlah fraksi mol dari zat terlarut dan zat pelarut harus sama dengan 1. Istilah yang sering digunakan yaitu persen mol (% mol).
XA = nA : (nA + nB + nC + …)
b. Molalitas
Molalitas merupakan perbandingan antara jumlah mol zat terlarut dengan massa pelarut dalam kilogram. Sehingga 1 molal mengandung 1 mol zat terlarut tiap 1 kg pelarut.
Molalitas = mol zat terlarut : kg pelarut
c. Normalitas
Normalitas didefinisikan sebagai satuan konsentrasi yang dihitung dari banyaknya zat dalam gram ekuivalen dalam 1 liter larutan dengan satuan N.
N = (gram zat terlarut : BE) x (100 : mL larutan)
d. Molaritas
Molaritas merupakan banyaknya mol zat terlarut dalam 1 L larutan.
Molaritas = mol zat terlarut : liter larutan
3. Pengenceran
Larutan berkonsentrasi tinggi atau larutan pekat sering disimpan di laboratorium dan digunakan sesuai kebutuhan. Sehingga sering dilakukan pengenceran larutan, yaitu prosedur untuk penyiapan larutan yang kurang pekat dari larutan yang lebih pekat.
Pada proses pengenceran, penambahan lebih banyak pelarut ke dalam sejumlah larutan tertentu larutan stok akan mengurangi konsentrasi larutan tanpa mengubah jumlah mol zat terlarut yang terdapat dalam larutan.
Dengan kata lain, mol zat terlarut sebelum pengenceran sama dengan mol zat terlarut setelah pengenceran. Karena semua zat terlarut berasal dari larutan awal dapat disimpulkan bahwa:
M awal x V awal = M akhir x V akhir
M awal dan M akhir adalah konsentrasi awal dan konsentrasi akhir larutan dalam molaritas. V awal dan V akhir adalah volume awal dan volume akhir serta harus memiliki satuan yang sama (Chang, 2004).
4. Sifat Koligatif Larutan
Suatu zat terlarut ketika dilarutkan dalam suatu pelarut maka sifat larutan itu berbeda dari sifat pelarut murni. Terdapat empat sifat fisika yang berubah secara perbandingan lurus dengan banyaknya partikel zat terlarut yang terdapat tekanan uap, titik beku, titik didih, dan tekanan osmotik.
Sifat yang bergantung pada banyaknya partikel zat terlarut dan tidak pada macam zat terlarut tersebut disebut sebagai sifat koligatif larutan. Sejauh mana sifat suatu larutan berubah berbanding dengan sifat pelarut murni dinyatakan oleh hukum koligatif. Selisih tekanan uap, titik beku, dan titik didih suatu larutan dengan tekanan uap, titik beku, dan titik didih pelarut murni berbanding langsung dengan konsentrasi molal zat terlarut (Chang, 2004). Artikel lebih lengkap tentang sifat koligatif larutan dapat kamu baca pada artikel rekomendasi berikut ini:
BACA: 4 Sifat Koligatif Larutan Elektrolit dan Non Elektrolit
Sifat koligatif larutan non elektrolit disebut suatu larutan ideal yaitu larutan yang memiliki konsentrasi sangat encer, sekitar <0,2M.
Sifat koligatif larutan terdiri dari 4 jenis, yaitu penurunan tekanan uap, kenaikan titik didih, penurunan titik beku, dan tekanan osmosis. Berikut ini adalah 4 sifat-sifat koligatif larutan:
a. Penurunan Tekanan Uap
Jika zat terlarut bersifat tidak mudah menguap (non volatil) artinya tidak memiliki tekanan uap yang dapat diukur, tekanan uap dari larutan selalu lebih kecil daripada pelarut murninya. Sehingga hubungan antara tekanan uap larutan dan tekanan uap pelarut bergantung pada konsentrasi zat terlarut dalam larutan. P1 adalah tekanan uap murni.
P1 = x1 . P1o
Dalam larutan yang mengandung hanya satu zat terlarut x1 = 1 - x2, dimana x2 adalah fraksi mol zat terlarut. Dapat disimpulkan:
P1 = (1 - x2) P1o
P1o - P1 = ΔP = x2 . P1o
Penurunan tekanan uap berbanding lurus terhadap konsentrasi (diukur dalam fraksi mol) zat terlarut yang ada.
b. Kenaikan Titik Didih
Keberadaan zat terlarut yang tidak mudah menguap menurunkan tekanan uap larutan sehingga titik didih larutan juga terpengaruh. Titik didih larutan merupakan suhu saat tekanan uap larutan sama dengan tekanan suhu pada saat tekanan uap larutan sama dengan tekanan atmosfer luar. Kenaikan titik didih didefinisikan:
Dimana Td adalah titik didih larutan dan Tdo adalah titik didih pelarut murni. Kenaikan titik didih berbanding lurus dengan penurunan tekanan uap sehingga berbanding lurus dengan konsentrasi larutan.
c. Penurunan Titik Beku
Larutan memiliki titik beku rendah dibandingkan pelarut. Hal tersebut disebabkan pembekuan melibatkan transisi dari keadaan tidak teratur ke keadaan teratur. Agar proses itu terjadi energi harus diambil dari sisten karena larutan lebih tidak teratur dibandingkan pelarut, maka lebih banyak energi yang diambil untuk menciptakan keteraturan dibandingkan pelarut murni. Penurunan titik beku didefinisikan sebagai:
ΔTb = Tb - Tbo
Dimana Tb adalah titik beku larutan dan Tbo adalah titik beku pelarut murni. Kenaikan titik beku berbanding lurus dengan berbanding lurus dengan konsentrasi larutan.
d. Tekanan Osmotik
Gerakan bersih molekul pelarut melewati membran semi permiabel dari pelarut murni atau dari larutan encer ke larutan yang lebih pekat disebut osmosis. Tekanan osmosit dalam suatu larutan adalah tekanan yang diperlukan untuk menghentikan osmosis. Tekanan osmosis dapat dinyatakan sebagai:
π = M . R. T
Dimana M adalah molaritas larutan, R adalah konstanta gas (0,082 L/atm K.mol) dan T adalah suhu mutlak. Tekanan osmotic dinyatakan bahwa dalam atmosfir, karena pengukurannya dilakukan pada suhu tetap. Seperti halnya sifat lain, tekanan osmotic juga berbanding lurus dengan konsentrasi larutan (Chang, 2004).
Pada kenyataannya, sifat koligatif larutan elektrolit biasanya bernilai lebih kecil dari yang diperhitungkan karena pada konsentrasi yang lebih tinggi, gaya elektrostatik berpengaruh sehingga kation dan anion saling tarik menarik. Pembentukan satu pasangan ion menurunkan jumlah partikel dalam larutan sebanyak satu, mengakibatkan berkurangnya sifat koligatif (Chang, 2004).
C. Alat dan Bahan
Alat-alat yang digunakan pada percobaan ini adalah gelas beaker 100 mL, gelas beaker 250 mL, pipet ukur 10 mL, pipet ukur 1 mL, pipet ukur 5 mL, labu ukur 50 mL, labu ukur 100 mL, gelas arloji, pengaduk kaca, bola hisap, sendok sungu, termometer, hotplate, statif, label, dan botol akuades.
Bahan-bahan yang digunakan pada percobaan ini adalah akuades, larutan HCl pekat, NaCl, pelet NaOH, dan sukrosa.
D. Cara Kerja
Percobaan pertama yaitu mempersiapkan larutan asam dan basa dengan berbagai konsentrasi. Larutan HCl dan NaOH diencerkan dalam 50 mL akuades:
- 0,4 mL untuk membuat 50 mL HCl 0,1M
- 1,35 mL untuk membuat 50 mL HCl 1%
- 2 gram NaOH untuk membuat 50 mL NaOH 1M
- 1 gram NaOH untuk membuat 100 mL NaOH 1M
Percobaan kedua yaitu membuat larutan sukrosa dengan berbagai konsentrasi. Sukrosa sebanyak 15; 30; dan 45 gram masing-masing dimasukkan ke dalam gelas beaker dan ditambahkan 50 mL akuades. Larutan kemudian dipanaskan hingga mendidih dan diukur suhunya menggunakan termometer lalu dihitung molalitas dan molaritasnya.
Percobaan ketiga yaitu membuat larutan NaCl dengan berbagai konsentrasi. NaCl sebanyak 3; 6; dan 9 gram masing-masing dimasukkan ke dalam gelas beaker dan ditambahkan 50 mL akuades. Larutan kemudian dipanaskan hingga mendidih dan diukur suhunya menggunakan termometer lalu dihitung molalitas dan molaritasnya.
E. Data Hasil Pengamatan
1. Membuat larutan sukrosa dengan berbagai konsentrasi
|
No. |
Massa terlarut (g) |
Molalitas larutan (m) |
Perhitungan |
Percobaan |
||
|
Kenaikan titik didih (oC) |
Titik didih larutan (oC) |
Kenaikan titik didih (oC) |
Titik didih larutan (oC) |
|||
|
15,029 |
0,878 |
0,456 |
100,456 |
-5,5 |
94,5 |
|
|
2. |
30,07 |
1,758 |
0,914 |
100,914 |
-5,5 |
94,5 |
|
3. |
45,06 |
2,635 |
1,3702 |
101,370 |
-5 |
95 |
2. Membuat larutan garam dengan berbagai konsentrasi
|
No. |
Massa terlarut (g) |
Molalitas larutan (m) |
Perhitungan |
Percobaan |
||
|
Kenaikan titik didih (oC) |
Titik didih larutan (oC) |
Kenaikan titik didih (oC) |
Titik didih larutan (oC) |
|||
|
1. |
3,03 |
1,035 |
1,077 |
101,077 |
0 |
100 |
|
2. |
6,04 |
2,064 |
2,146 |
102,146 |
2 |
102 |
|
3. |
9,02 |
3,083 |
3,206 |
103,206 |
5 |
105 |
F. Pembahasan
Percobaan yang dilakukan berjudul “Sifat Fisik Larutan: Pengenceran dan Sifat Koligatif”. Tujuan dari percobaan ini adalah mampu melakukan perhitungan untuk mengkonversi satu konsentrasi ke konsentrasi lainnya dan memahami hubungan antara konsentrasi dan sifat koligatif, dalam hal ini kenaikan titik didih, baik pada larutan elektrolit maupun non elektrolit. Prinsip kerja pada percobaan ini adalah pengenceran dan kenaikan titik didih.
Pengenceran merupakan penambahan zat terlarut sehingga jumlah zat terlarut sebelum pengenceran sama dengan jumlah mol zat terlarut sesudah pengenceran. Proses pengenceran adalah mencampur larutan pekat dengan cara menambahkan pelarut agar diperoleh volume akhir yang lebih besar. Kenaikan titik didih merupakan selisih antara suhu titik didih larutan pada percobaan dengan titik didih pelarut murni dalam percobaan.
Percobaan pertama menggunakan prinsip kerja pengenceran untuk pembuatan larutan 50 mL HCl 0,1M, 50 mL HCl 1% (b/b), 50 mL NaOH 1m, dan 100 mL NaOH 1% (b/v). pada pengenceran yang pertama yaitu melakukan pengenceran HCl. HCl pekat yang diencerkan sebesar 37%. Pengenceran HCl dilakukan untuk larutan yang berkonsentrasi 0,1M dan larutan HCl 1%. Dalam pengenceran ini larutan HCl pekat diencerkan dalam 50 mL larutan dengan zat pelarutnya akuades. Penambahan lebih banyak pelarut ke dalam sejumlah tertentu larutan akan mengurangi konsentrasi larutan tanpa mengubah jumlah mol zat terlarut yang terdapat dalam larutan.
Langkah berikutnya yaitu melakukan pengenceran NaOH. Padatan NaOH bersifat mudah mencair pada udara terbuka karena memiliki sifat higroskopis dan mampu menurunkan kelembapan udara serta mengadsorbsi karbon dioksida dari udara. Hal ini mengakibatkan timbulnya air di sekitar padatan NaOH saat terkena udara. Pada saat larutan NaOH dilarutkan dengan akuades larutan tersebut terasa panas. Hal ini disebabkan adanya reaksi eksoterm yaitu perpindahan kalor dari sistem ke lingkungan, sehingga suhu lingkungan naik disertai pengeluaran panas. Semakin banyak NaOH yang dilarutkan dalam air, maka suhunya semakin tinggi.
Kelarutan suatu zat dapat dipengaruhi oleh beberapa faktor diantaranya suhu dan tekanan. Banyak zat yang ketika dilarutkan dengan air panas akan lebih cepat larut. Pada percobaan ini digunakan NaOH yang memiliki tingkat kelarutan yang tidak kecil sehingga tanpa dipanaskan padatan sudah dapat larut.
Percobaan kedua yaitu pengamatan kenaikan titik didih pada larutan dilakukan dengan menggunakan larutan sukrosa (C12H22O11) dengan berbagai konsentrasi. Percobaan ini dilakukan secara kualitatif bertujuan untuk mengetahui titik didih larutan. Sukrosa merupakan zat yang mudah larut dalam air dan di dalam pelarutan terdapat reaksi endoterm yang menyebabkan larutan terasa dingin. Persamaan reaksi yang terjadi sebagai berikut:
C12H22O11(s) + H2O(l) → C12H22O11(aq) + H2O(aq)
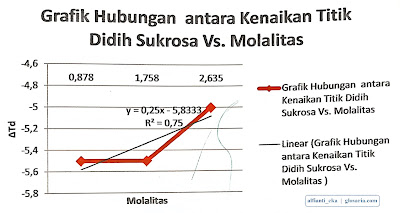
Secara teori penambahan massa pada larutan akan menaikkan sifat koligatif larutan dalam hal ini kenaikan titik didih. Jumlah zat terlarut akan mempengaruhi besarnya konsentrasi zat yaitu molalitas sehingga semakin banyak massa zat terlarut akan meningkatkan titik didih konsentrasi mempengaruhi sifat koligatif yaitu berbanding lurus. Hal tersebut tidak sesuai dengan percobaan yang telah dilakukan karena titik didih yang dihasilkan tidak mengalami kenaikan.
Kesalahan ini terjadi dikarenakan pada saat pemanasan larutan sukrosa, suhu yang diukur menggunakan termometer belum sepenuhnya mendidih total. Kenaikan titik didih yang didapatkan bernilai negatif karena digunakan titik didih pelarut murni (Tdo) secara teori yaitu 100oC. Berikut grafik hubungan antara kenaikan titik didih sukrosa dengan molalitas:
Percobaan selanjutnya yaitu pengamatan kenaikan titik didih pada larutan NaCl dengan berbagai konsentrasi. Sebanyak zat terlarut dilarutkan dalam 50 mL akuades dan dipanaskan sampai mendidih. NaCl merupakan larutan elektrolit sehingga NaCl tidak terdiri dari molekul melainkan pasangan ion Na+ dan ion Cl-. Nilai ionisasi dari NaCl dua kali lipat daripada larutan non elektrolit. Persamaan reaksi yang terjadi sebagai berikut:
NaCl(s) + H2O(l) → Na+(aq) + Cl-(aq) + H2O(aq)
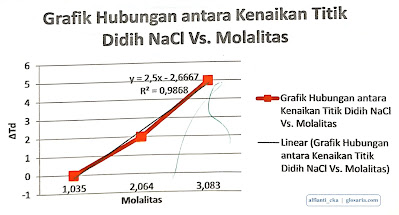
Pada percobaan ini mengalami kenaikan titik didih. Hal tersebut telah sesuai dengan teori karena semakin banyak zat terlarut maka semakin banyak pula kenaikan titik didihnya. Berikut grafik hubungan antara kenaikan titik didih NaCl dengan molalitas:
Berdasarkan hasil percobaan didapat bahwa kenaikan titik didih NaCl lebih besar daripada kenaikan titik didih sukrosa. Hal tersebut terjadi karena larutan NaCl merupakan larutan elektrolit sedangkan sukrosa merupakan larutan non elektrolit. Terdapat faktor Van Hoff pada larutan elektrolit sehingga meskipun dalam percobaan ini variasi massa pada NaCl lebih kecil namun titik didih NaCl lebih besar dibandingkan dengan titik didih sukrosa.
G. Kesimpulan
Berdasarkan percobaan Sifat Fisik Larutan: Pengenceran dan Sifat Koligatif, dapat disimpulkan bahwa:
1. Hasil percobaan perhitungan mengkonversi satu konsentrasi ke konsentrasi lainnya didapatkan:
- 0,4 mL untuk membuat 50 mL HCl 0,1M
- 1,35 mL untuk membuat 50 mL HCl 1%
- 2 gram NaOH untuk membuat 50 mL NaOH 1M
- 1 gram NaOH untuk membuat 100 mL NaOH 1M
2. Hubungan konsentrasi dan kenaikan titik didih adalah semakin besar konsentrasi suatu larutan maka semakin tinggi pula kenaikan titik didihnya. Begitu pula sebaliknya, semakin kecil konsentrasi suatu larutan maka semakin kecil titik didihnya.
H. Daftar Pustaka
- Baroroh, Umi. 2004. Diktat Kimia Dasar I. Banjarmasin: Universitas Lambung Mangkurat.
- Brady, J. E. 1992. Kimia Universitas Asas dan Struktur. Jakarta: Bina Rupa Aksara.
- Chang, R. 2004. Kimia Dasar: Konsep-konsep Inti Jilid 2. Jakarta: Erlangga.
- Keenan, W. 1992. Kimia untuk Universitas Jilid 1. Jakarta: Erlangga.

Posting Komentar untuk "Laporan Praktikum Sifat Koligatif Larutan dan Pengenceran"